TAKÁCS CSABA KÉMIA EMLÉKVERSENY,
X.-XII. osztály, I. forduló - megoldás
2008 / 2009 –es tanév, XIV. évfolyam
A feladatlapon szereplő forrásanyagok, a Pécsi Diákszimpozium kiadványkötetei, olvashatók a http://www.aok.pte.hu/bioanal/kemia/szimpozium.htm internet címen.
1. a) Ahhoz, hogy két C-atom között újabb kovalens kötés alakuljon ki mindig páros számú H-atomot kell eltávolítani, mert az így szabaddá vált vegyértékelektronok összekapcsolódva új kötést alakítanak ki. (0,75 p)
b) Ez a szám megmutatja, hogy az adott szénhidrogénből hány pár H-atom hiányzik ahhoz, hogy telített legyen [lásd a)-választ is)]. (0,5 p)
c) Egy C-láncban egy gyűrű vagy egy pi-kötés egy telítetlenségi értéket jelent. A feltételezett szénhidrogénben: 2 gyűrű + 3 pi-kötés (C=C kötésekből) + 4-pi-kötés (CºC kötésekből) = 9 T.sz. (0,75 p)
d) A legtelítetlenebb lehetséges szerkezetek: H2C=C=C=C=CH2 vagy
HCºC−CH2−C ºCH vagy HCºC−CºC−CH3 vagy HCºC−CH=C=CH2 stb. (2x0,25=0,5 p)
Tehát a T.sz. = 4 és molekulaképlet: C5H4 (0,5 p)
e) Bármely nyíltszénláncú szénhidrogénben a minimális H-atomok száma: y=4 [ásd d)-válasz] szerkezeteit], mert a maximális telítetlenség esetén csak a C-lánc szélső C-atomjaihoz kerülhetnek H-atomok. (1,0 p)
f) „Papír forma” szerint valójában ezek lennének a legegyszerűbb ciklikus alifás szénhidrogének, de egyik sem létező vegyület, a molekulán belül kialakuló belső feszültség miatt. (0,5 p)
A ciklopropánban C − C kötések vannak , ezek vegyértékszöge 109o28᾽ kell legyen, viszont a gyűrűs szerkezetben csak 60o-os. (0,5 p)
A cikloprpénben a C=C kötések 120o-osak és a C−C kötések 109o28᾽ kellene
legyenek, de ebben az egyenlő szárú háromszög szerkezetbe két szögérték 60o-nál kisebb.
(0,5 p)
A cikloprpinban a CºC kötések 180o-osak kellene legyenek (tovább lásd a fenti választ)!
(0,5 p)
g) Az alkánok C-atomjai sp3 hibridállpotúak (109o28᾽ vegyértékszög), ebből következik, hogy a C-lánc zegzugos szerkezetű kell legyen és a C-atomhoz kapcsolódó H-atomok nem lehetnek egy síkban: C-lánc síkjainak egyik vagy másik oldalán vannak (tetraéderes szerkezetnek megfelelően). (1,0 p)
h) Az első szembetűnő tévedés matematikai jellegű, mert arányok estében a legkisebb számokkal kifejezhető viszonyt szokták megadni, tehát a 2 : 4 helyett 1 : 2 kellene. Kémiailag lehetetlen, mert a CnH2n+2 alkán általános képlet alapján: n /2n+2 = 2/4 = 1/2 Þ
2n = 2n+2 Þ 0 = 2n Þ n = 0 , tehát nem lehet alkán (lehet esetleg H2!!!) (1,0 p)
Tankönyv: Kémia X., Ed. Crepuscul, 2005, 35.old/6
i) A 16 szigma-kötést tartalmazó alkán kémiai összetétele: C5H12. Ennek az alkánnak a legalacsonyabb forráspontú izomerje a 2,2-dimetil-propán, mert ennek térszerkezete gömbalakú és az ilyen molekulák között fellépő kölcsönhatások a minimálisak. (A forráspont értéke függ a molekulák közötti kölcsönhatások erősségétől.) (1,0 p)
j) C4H10 + 13/2 O2® 4CO2 + 5H2O(g) reakcióegyenlet és az égési körülmények alapján 1 tf. butánból 9 tf. gázállapotú termék keletkezik. (Az égési folyamat körülményein a víz gázállapotú.) (0,75 p)
k) A n-hexán lehetséges izomérjei:
![]()
![]()
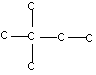
![]()
A IUPAC (International Union of Pure and Applied Chemistry = Tiszta és Alkalmazott Kémia Nemzetközi Egyesülete) szabályai szerint:
(1) - helyes elnevezés; (2) - nem helyes: 2-metil-pentán a helyes; (3) - helyes elnevezés; (4) - nem helyes: 2,2-dimetil-bután a helyes; (5) - nem helyes: 3-metil-pentán, az (1)-gyel azonos. (1,5 p)
2. (Forrásanyag: 1999 Pécsi Kémikus Diákszimpózium kiadványkötete)
a) Két ellentétes irányú folyamat játszódik le egymás mellett: az oldódás (keveredés) és a kiválás, amelyek különböző sebességűek, de egyre inkább közelítenek egymáshoz, majd egyenlővé válnak (ekkor lesz a keverék homogén). Megj. a megadott forrásanyagban két ellentétes reakació szerepel! (1,0 p)
b) Az oldódás (a) során megfigyelhető hőmérsékletváltozás addig tart, amíg a hőkiegyenlítődés beáll a rendszer és a környezete között.
A hőkiegyenlítődés két irányból valósulhat meg: az oldat hőt vesz fel a környezetből vagy hőt ad le annak. (1,0 p)
c) Exoterm az oldódás, ha az oldat ad át hőt a környezetének, és endoterm, ha a hő kívülről áramlik az oldatba. (0,5 p)
d) (1) Az oldáshő az 1 mól anyagból készített nagyon híg oldat hőváltozását fejezi ki. Mértékegysége: kJ/mol. (0,75 p)
(2) A pozitív előjelű oldáshő endoterm oldódást jelöl, míg a negatív előjelű oldáshő exoter folyamatot jelent, mivel itt hő távozik a rendszerből. (0,5 p)
3. a) cisz-2-pentén :
![]() a C=C
kettős kötés helyének megadása téves, mivel a számozást
a C-lánc azon végétől kell kezdeni, amelyhez közelebb
van a C=C kötés.(1,0 p)
a C=C
kettős kötés helyének megadása téves, mivel a számozást
a C-lánc azon végétől kell kezdeni, amelyhez közelebb
van a C=C kötés.(1,0 p)
b) 2,3-dimetil-bután:
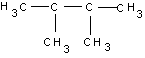 egy C-lánc végén nem
lehet elágazás (ez a főlánc része); ebben az esetben
az 1-es és 2-es C-atom a főlánc két végét jelenti. (1,0 p)
egy C-lánc végén nem
lehet elágazás (ez a főlánc része); ebben az esetben
az 1-es és 2-es C-atom a főlánc két végét jelenti. (1,0 p)
c) 2-oktén: H3C−CH=CH−CH2−CH2−CH2−CH2−CH3
- magyarázat az a) és b) válaszokban. (0,75 p)
d) 2-metil-2-butén
![]() - a főlánc
számozása a C=C kötés helyzete szerint történik (a)-válasz), majd
ezután következik az oldallánc helyének megadása.
(1,0 p)
- a főlánc
számozása a C=C kötés helyzete szerint történik (a)-válasz), majd
ezután következik az oldallánc helyének megadása.
(1,0 p)
e) ciklopentén ![]() - a cikloalkének
esetében (egy C=C kötést tartalmaznak) nem lehet
számozási sorrendet megadni - a zárt C-láncnak nincs eleje
és vége. (1,0 p)
- a cikloalkének
esetében (egy C=C kötést tartalmaznak) nem lehet
számozási sorrendet megadni - a zárt C-láncnak nincs eleje
és vége. (1,0 p)
f) 2,2-dimetil-2-butén -
nem létezik a C-atom 4 vegyértékállapota miatt: a képlete a következő
kellene legyen 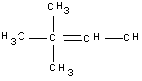
Megjegyzés: lehetséges lehetne a 2,3-dimetil-2-butén, amely két CH3-csoportot tartalmazhat a 2-butén főláncon:
![]() illetve más izomér,
stb. (0,75 p)
illetve más izomér,
stb. (0,75 p)
g) 3,4-dimetil-hexán
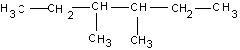 lásd b)-választ a
helyes megnevezésre (0,75 p)
lásd b)-választ a
helyes megnevezésre (0,75 p)
4. Az oldószerként etanolt (etil-alkoholt, C2H5-OH) tartalmazó oldatok általános megnevezése a „tinktúra”. (0,5 p)
A legismertebb a jód-tinktúra, amely I2-t és KI-ot tartalmaz etanolban feloldva. (0,75 p)
5. (Forrásanyag: 2001. Pécsi 2. Kémikus Diákszimpózium kiadványkötete)
a) Több, mint 200 féle hatóanyag és ebből 20 féle ásványi anyag. (0,5 p)
b) A-vitamin: hámvédő antioxidáns; B1-vitamin: idegrendszrvédő;
B2-vitamin: bőrképzési folyamat; B3-vitamin: anyagcseréhez szükséges;
B4-vitamin: vörösvértestek képződésében; B6-vitamin: idegrendszer működése;
B12-vitamin: vörösvértest képződés és aminosav anyagcsere;
C-vitamin: immunerősítő antioxidáns; E-vitamin: szaporodás antioxidánsa (2,5 p)
c) Ca - csonképzés, izomműködés, véralvadás; P - csontképződés;
Fe - hemoglobin alkotórésze; Na - sejtekben;
Cl - antiszeptikus hatású; Mn - bőr, izom, idegrendszer; Mg - izom és idegrendszer; Cu - hemoglobin felépítésében résztvevő enzimek;
Cr - sejtek inzulinérzékenysége; Zn - immunválasz. (2,5 p)
6. Feladat: Szerkezet megállapítás
a) poVo/To = pV/T Vo = 273x550/335 = 448,2 dm3CO2 Þ 20 mól CO2/ 0,5 mól A-szénhidrogén Þ
1 molekula A-ban 40 C-atom van. (0,75 p)
b) TSz-a (TE) = [(2x40+2)-X]/2 = 13; ha az A képlete: C40HX Þ X = 56, A: C40H56 (0,5 p)
c) / a teítésre elfogyott H2-gáz térfogata n.k.-en:
poVo/To = pV/T Vo = 273x199/373 = 145,6 dm3H2/ 0,5 mól A-szénhidrogén
1 mól A Þ 291,2 dm3 = 13 mól H2 gázal telítődik Þ 13 pi-kötés/molekula (1,5 p)
d) C40H56 Þ összetétel alapján, ha a főláncban 32 C-atom van és 8 C-atom oldalláncban, akkor az oldalláncok csak egy C-atomosak lehetnek; ezek CH3-cspportok. (0,5 p)
e) - a primer C-atomok száma nem lehet több, mint 10: 8 db. oldalláncként (d-válasz) és esetleg a főlánc két végén 1 - 1 CH3-csoport; (0,25 p)
- a lehetséges tercier C-atomok száma: 40 - 8 (kvaterner) - 4 (szekunder) - 8 vagy 10(primer) = 20 vagy 18 db. tercier C-atom/molekula (0,25 p)
- a konjugált szerkezeti részben nem lehetnek CºC kötések, mert akkor a kvaterner C-atomok száma sokkal több kellene legyen, mint 8 ! (0,5 p)
- tehát a konjugált részben csak C=C kötések lehetnek; (0,25 p)
- így ez a szerkezeti rész 11 db. pi-kötést tartalmaz, és mivel a molekula szimmetrikus szerkezetű, az 1 - 5 és 28 - 32 számú C-atomok közötti láncrészben még 1 - 1 C=C kötés kell legyen; (0,25 p)
- a konjugált szerkezeti egység a 6-os C-atomtól kezdődik (így lesz 11 db. pi-kötés); amennyiben a 6 - 27 C-atomos intervallumban a 7-es C-atomtól kezdődne a konjugált rész, akkor csak 10 db. pi-kötés lenne a szakaszon és a fennmaradó 3 db. pi-kötést nem lehet szimmetrikusan elhelyezni a molekula két végén! (0,5 p)
- a 2. és 31. C-atomok kvaternerek és d)-pont szerint -CH3 oldalláncot tartalmaznak(0,25 p)
- az 1 - 5 és 28 - 32 C-atomos láncrészen kell legyen még 1 - 1 pi-kötés, amely nem lehet konjugált helyzetben a 6 - 27 C-atomokkal, és ugyanakkor 2 - 2 szekunder C-atom is kell legyen; (0,5 p)
- több oldallánc a fenti láncrészen nem lehet (mert az csak kvaterner C-atomon van); (0,25 p)
- egyetlen lehetőség : C=C kötés a 2 - 3 illetve 30 - 31 C-atomok között; (0,5 p)
- így a C-lánc összesen 10 primer és 18 tercier C-atomot kell tartalmazzon; (0,5 p)
- a következő kvaterner C-atom a megadottak értelmében a 6. és 27. C-atom; (0,25 p)
- figyelembe véve a kvaterner C-atomok számát és egymáshoz viszonyított távolságát a 10., 14., 19. és 23. C-atomokon lesz -CH3 csoport. (0,75 p)
- az A szénhidrogén szerkezete:
H3C−C(CH3)=CH−CH2−CH2−C(CH3)=CH−CH=CH−C(CH3)=CH−CH=CH−C(CH3)=CH−CH=
=CH−CH=C(CH3)−CH=CH−CH=C(CH3)−CH=CH−CH=C(CH3)−CH2−CH2−CH=C(CH3)−CH3 (1,0 p)
f) 2,6,10,14,19,23,27,31-oktametil-dotriakonta-2,6,8,10,12,14,16,18,20,22,24,26,30-tridekán; (0,75 p)
g) A természetben pl. a paradicsom, csipkebogyó, piros paprika stb. színanyaga, amely likopin néven vált ismertté. Ez az elnevezés a paradicsom latin nevéből (Solanum lycopersicum) származik. (0,75 p)
h) E 160 - számmal használt adalék. (0,25 p)
7. Kísérlet
a) A „szűrőbetét” = aktív szén, olyan porózus anyag, amely nem megszűri, hanem a felületén megköti a káros anyag molekuláit. (0,75 p)
b) (1) A C-poron átcsepegő folyadék (=szűrlet) színtelen, ami azt bizonyítja, hogy a tinta kék színét adó komponens nem ment át a szűrőpapíron (megkötődött a C-por felületén);
(1,25 p)
(2) Párszor megismételve az (1)-es folyamatot, a szűrletek egyre inkább kék színűvé válnak (megfelelő számú ismétlés után az erdetei oldat színével lesz azonos a szűrlet). Ez is azt bizonyítja, hogy az aktív C-por nem megszűri, hanem megköti a színezéket, de amikor a felülete telítődött, akkor több molekulát nem tud megkötni (nincs több szabad felület) és akkor az átmegy a szűrőpapíron. (1,5 p)
c) A folyamat neve: „adszorpció” = felületi megkötődés. A porózus C-por a színezék molekulákat fizikailag köti meg (0,75 p)
d) A c)-pont válaszából következik, hogy ugyancsak fizikai tényezők hatására a megkötődött molekulák leválnak a porózus C-por felületéről és ezért a szűrlet kék színű lesz. (0,75 p)
8. Rejtvény: Egymást követő és kétszeres értékek - Sudokuban
a) (4,0 p)
|
6 * K |
5 E N |
2 * S |
4 É Z |
7 * K |
1 * S |
9 * L |
8 * K |
3 H N |
|
1 * A |
9 Á S |
4 A M |
3 É Z |
8 A N |
6 Á T |
2 H N |
7 É S |
5 A S |
|
8 A I |
3 * S |
7 A N |
9 A V |
2 Z É |
5 * K |
4 K O |
1 E Z |
6 A L |
|
3 D I |
4 * K |
6 A K |
1 E S |
5 O T |
9 G L |
8 L M |
2 É G |
7 O F |
|
5 Á J |
8 A T |
1 R V |
7 L Ő |
6 Í T |
2 O R |
3 É G |
4 E R |
9 A L |
|
7 * E |
2 D I |
9 F O |
8 N U |
3 O R |
4 S Z |
5 S S |
6 A H |
1 * K |
|
9 K O |
1 É M |
5 Á G |
2 * K |
4 E Z |
7 L U |
6 Á G |
3 Á R |
8 Á Z |
|
2 E N |
7 D R |
8 Á N |
6 Á S |
9 I Z |
3 S Z |
1 * A |
5 A N |
4 É T |
|
4 E K |
6 Ó T |
3 * N |
5 A I |
1 A I |
8 O Y |
7 Á S |
9 * K |
2 É S |
b) „*A*SZERVES*KÉMIA*A*SZÉNHIDROGÉNEK*ÉS*SZÉNHIDROGÉN*SZÁRMAZÉKOK*SZERKEZETÉNEK,*
SAJÁTOSSÁGAINAK*ÁTALAKÍTHATÓSÁGÁNAK*ÉS*ELŐFORDULÁSAINAK*TANULMÁNYOZÁSÁVAL*
FOGLALKOZIK*” (2,0 p)
Megjegyzés: a feladatlapon a betűk összeolvasási szabályaiból kimaradt egy fontos „lépés” ezért az erre megadott 2,0 pontot minden versenyző megkapja!!!
FONTOS: a feladatlapok kitöltését elvégezheted ebben a word-dokumentumban, vagy leírhatod csak a megoldásokat (a feladatok számát feltüntetve) ugyancsak word dokumentumban. Mindkét esetben visszaküldheted a versenyfelhívásban megadott e-mail címre, vagy kinyomtatva postai küldeményként (a megadott postai címre). A scannelést lehetőleg mellőzni kell, mert elég sok bonyodalmat okozott az előző években is, így megtörténhet, hogy használhatatlan a javításra visszaküldött válasz.
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
(Forrásanyag: 2001. Pécsi 2. Kémikus Diákszimpózium kiadványkötete)
9. a) A kifejezés a halogénezett szénhidrogének angol megnevezéséből származik: „halogenated hydrocarbon”. (Megj. a „halon” elnevezés gyűjtőnév és márkanév is.) (0,5 p)
b) A számjelölés első száma a C-atomok, a második a F-atomok, a harmadik a Cl-atomok, a negyedik a Br-atomok, az ötödik pedig a I-atomok számát jelöli. Amennyiben az összetételből valamelyik halogénatom hiányzik, helyére „0” kerül (kivéve, ha a I-atom hiányzik, mert ezt az utolsó szám jelöli és akkor a „0”-t nem írjuk k). (1,5 p)
c) A legkiválóbb tűzoltó hatású halonok összetételében több F-, és Br-atom található. A halonok tűzoltó hatása abban nyilvánul meg, hogy az égési reakciókban (láncreakció) blokkolják a gyököket, amelyek továbbvihetnék az égési folyamatot. Ehhez az szükséges, hogy a halonok is szabadgyökké váljanak viszonylag alacsony hőmérsékleten.
A több F-atom „leárnyékolja” a C-atomot a külső termikus hatások ellen, mivel a C- és F-atomok méretviszonyai nagy energiájú kötéseket hoznak létre, így ezek nehezen válnak szabadgyökké. A Br jelenléte a halonban biztosítja a C-Br kötés kis stabilitása miatt azt, hogy kisebb hőmérsékleten viszonylag könnyen keletkeznek szabad gyökök.(1,5 p)
d) 1900 körül ismerték fel a CCl4 tűzoltó képességét. A Cl-nak rendkívül magas ára miatt nem történt meg általános tűzoltói alkalmazása. Jelölése: 10400 vagy 104 (1,0 p)
e) A CCl4 - t 1910-től kezdték árusítani, kezdetben gépkocsimotor-tüzek oltására, később
repülőgép- és mozdonytüzek oltóanyaga lett CTC-nven =(carbon-tetra-chlorid). (0,75 p)
f) 1011; klór-bróm-metán: CH2ClBr 1202; difluor-dibróm-metán: CF2Br2
1211; difluor-klór-bróm-metán: CF2ClBr 1301; trifluor-bróm-metán: CF3Br
2402; tetrafluor-dibróm-etán: C2F4Br2 (1,25 p)
g) A halonok mérgezőképességük alapján:(1)-hidegen- és (2)-melegen mérgezőek.(0,25 p)
(1) A hidegen mérgezőség azt jelenti, hogy szobahőmérsékleten mérgezőhatást fejt ki az a mennyiség, amelynek belélegzése 15 perc után halált okozhat (halálos dózis=dosis letalis º DL) (0,75 p)
Ezért a gyakorlatban csak azok a halonok kerülhetnek forgalomba, amelyeknél a DL mennyisége lényegesen nagyobb, mint amennyi a hatékony tűzoltáshoz kell.(0,5 p)
(2) A melegen mérgezőség azt jelenti, hogy magasabb hőmérsékleten tapasztalható ez a hatás. Magas hőmérsékleten a halonok bomlanak, a bomlástermékek mérgező hatása nagyobb, mint a kiinduló haloné. Ezért melegen tűzoltásra csak olyan mennyiségben alkalmazható, hogy a halon és a bomlástermékeinek mennyisége ne lépje túl a fenti megengedett határt! (0,75 p)
h) Ózonkárosító hatásúak; magas légköri élettartamúak és jelentősen befolyásolják a
Föld felmelegedését (=üveghézhatás) (0,5 p)
i) Bécsi Jegyzőkönyv, 1985 március 22 és Montreali Jegyzőkönyv, 1987 szeptember
16 (0,25 p)
j) (1) fluór-klór-dibróm-etán: C2H2FClBr; (2) fluór-klór-bróm-jód-metán: CFClBrI.
(0,5 p)
Tudod – e?
1880 – ban kb. 12.000, 1900 – ban kb. 80.000, 1960 – ban kb. 1.750.000, míg 2000 körül kb. 4.000.000 volt az ismert és lexikálisan nyilvántartott szerves vegyületek száma. (Ennél sokkal több létezik – 10 milliónál többre becsülik a számukat - de feltehetőleg nincs gyakorlati jelentőségük, így lexikálisan nem kerültek nyilvántartásba.)
Az emberi szervezet felépítésében résztvevő bioelemek atomszázalékban kifejezve a következők:
H (64%), O (25,5%), C (9,5%), N (1,4%), Ca (0,31%), P (0,22%), Cl (0,08%), K (0,06%),
S (0,05%), Na (0,03%), Mg (0,01%).
A buténdisav treansz szerkezetű izomérje a fumársav sok növényben (gombák, zuzmók, stb.) fellelhető, kis mennyiségben pedig minden állati szervezetben is megtalálható, ahol a cukrok metabolizmusában van fontos szerepe. A maleinsavnak nevezett cisz-izomér nem fordul elő a természetben!
Az izopropilalkohol (2-propanol) a másológépek, faxok, audio- és video felvevő készülékek, elektromos berendezések hatékony tisztítószere. 70 %-os vizes oldatát az egészségügyben fertőtlenítésre használják.