TAKÁCS CSABA KÉMIA EMLÉKVERSENY,
X.-XII. osztály,III. forduló - megoldás2008 / 2009 –es tanév, XIV. évfolyam
1. a) Az annulének folyamatosan konjugált kettős kötést tartalmazó gyűrűs szénhidrogének. Általános képletük: (CH)n , ahol n = 4,6,8,….. (1,5 p)
b) Páratlan számó C-atomból álló gyűrű nem tartalmazhat folyamatosan konjugált kettős kötéseket. (0,75 p)
c) Az a)-pont válaszából következik, hogy az annulének C-atomjai mind sp2 hibridállapotúak. (0,75 p)
d) [4] annulén: ![]() ciklobutadién; [6] annulén:
ciklobutadién; [6] annulén: ![]() ciklohexatrién = benzol (1,75 p)
ciklohexatrién = benzol (1,75 p)
[8] annulén: ![]() ciklooktatetraén (1,0 p)
ciklooktatetraén (1,0 p)
[18] annulén: 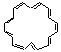 ciklooktadekanonén
(1,5 p)
ciklooktadekanonén
(1,5 p)
e) n C-atom esetén n db. p-elektron van a molekulában (0,5 p)
2. a) G; b) A; c) C; d) H; e) G; f) C; g) D; h) F; i) A; j) B; k) D; l) C;
m) E; n) C; o) F; p) E; r) H; s) H; t) B; u) F. (20x0,15= 3,0 p)
Reakciók:
a) C6H12O6 ® 2C2H5OH + 2CO2 (0,25 p)
b) H3C-CH3 ® H2C=CH2 ® HO-CH2-CH2-OH (0,25 p)
c) C6H5-CH3 + 3HNO3 ® 2,4,6-C6H2-CH3(NO2)3 + 3H2O (0,5 p)
e) H3C-CH2OH ® H2C=CH2 ® H3C-CH3 (0,25 p)
g) HCºCH + 4[O] ® HOOC-COOH (0,25 p)
h) H2C=CH-CH=CH2 + 10[O] ® HOOC-COOH + 2CO2 + 2H2O (0,5 p)
i) C3H8 + 5O2 ® 3CO2 + 4H2O és C4H10 + 13/2O2 ® 4CO2 + 5H2O (0,5 p)
j) 2CH3OH ® H3C-O-CH3 + H2O (0,25 p)
k) 3H3C-CºCH ® 1,3,5-C6H3(CH3)3 (0,5 p)
l) C6H5-CH3 + CH3Cl ® orto- és para-C6H4(CH3)2 + HCl (0,25 p)
m) nH3C-CH=CH2 ® -(HC(CH3)-CH2)n- (0,5 p)
n) C6H6 ® ciklo-C6H12 (0,25 p)
o) H2C=CH-CH=CH2 + H2 ® H3C-CH=CH-CH3 (0,5 p)
p) H3C-CH=CH2 + Cl2 ® H3C-CHCl-CH2Cl
H3C-CHCl-CH2Cl + Cl2 ® ClCH2-CHCl-CH2Cl
ClCH2-CHCl-CH2Cl + 3H2O ® HOCH2-CH(OH)-CH2OH (0,75 p)
t) HCOOH + CH3OH ® HCOOCH3 + H2O (0,5 p)
u) nH2C=C(CH3)-CH=CH2 ® -(H2C-C(CH3)=CH-CH2)n- (0,5 p)
3. a1) 2H2C=CH-CH2 ® H2C=C(CH3)-CH2-CH2-CH3 2-metil-1-pentén (A) (1,25 p)
a2) H2C=C(CH3)-CH2-CH2-CH3 ® H3C-C(CH3)=CH-CH2-CH3
2-metil-2-pentén (B) (0,75 p)
a3) H3C-C(CH3)=CH-CH2-CH3 ® H2C=C(CH3)-CH=CH2 + CH4 (0,75 p)
b1) HCºCH + O=C(CH3)2 ® HCºC-C(CH3)(OH)-CH3
3-hidroxi-3-metil-1-butin (C) (1,25 p)
b2) HCºC-C(CH3)(OH)-CH3 ® H2C=CH-C(CH3)(OH)-CH3
3-hidroxi-3-metil-1-butén (D) (1,0 p)
b3) H2C=CH-C(CH3)(OH)-CH3 ® H2C=C(CH3)-CH=CH2 + H2O (0,75 p)
4. a) Ez azon kevés műanyagok egyike, amely vízben oldódik. (0,25 p)
b) PVA (0,25 p)
c) A monomer képlete: H2C=CH-OH, amely egy instabil vegyület: azok a hodroxi-származékok, amelyekben az -OH csoport nem aromás gyűrű sp2 hibridállapotú C-atomjához kapcsolódnak, instabilak (konjugációs effektus miatt) és tautomerizációval átalakulnak stabil karbonil vegyületekké. Tehát, amennyiben a monomer nem létezik, így nem is polimerizálható. (1,0 p)
d) A fenti polimert a vinil-acetát polimerizációjából keletkezett termék hidrolízisével állítják elő: (1,0 p)
HCºCH + H2O ® (H2C=CH-OH) ® CH3CHO ® CH3COOH (0,75 p)
HCºCH + CH3COOH ® H2C=CH-O-COCH3 (0,5 p)
nH2C=CH-O-COCH3 ® -[H2C-CH(O-COCH3)]n - polivinilacetát (0,25 p)
-[H2C-CH(O-COCH3)]n - ® -[CH2-CH(OH)]n - + nCH3COOH (0,5 p)
e) - biológiailag lebontható polimer (0,25 p)
- az oldékonyság (vízben) függ a polimerizációfoktól és a hőmérséklettől: minél több egységből áll a polimer, annál kevésbé oldódik vízben; (0,5 p)
- 100o C fölött bomlik (0,25 p)
- antisztatikus tulajdonságú = elektromosan nem töltődik fel (0,25 p)
- rugalmatlan. (0,25 p)
5. A növények fotoszintézise: CO2 és H2O fény jelenlétében termeli az élet fenntartásához szükséges O2-t: 6CO2 + 6H2O ® C6H12O6 + 6O2 (0,75 p)
Amikor nincs természetes fény a fenti folyamat nem megy végbe, így a fordított irányú átalakulás dominál, amely oxigén fogyasztó és CO2 termelő folyamat. (0,5 p)
Ez utóbbi két folyamat éjszaka, zárt helységben az alvó embernek azért káros, mert a légzéséhez szükséges oxigént fogyasztja és ugyanakkor a légzést nem tápláló CO2 - t termeli. (0,5 p)
6. a) A naftalint (szilárd) fel lehet oldani benzolban (folyékony), mivel mindkét vegyület apoláris jellegű molekulákból áll: a hasonló szerkezetű anyagok egymásban oldódnak.
(1,5 p)
M(naftalin) ® M(C10H8) = 128; M(benzol) ® M(C6H6) = 78
n(naftalin) = 32/128 = 0,25 mól naftalin; n(benzol) = 78/78 = 1 mól benzol (1,5 p)
b1) w = 32/(32+78) = 0,2909 b2) x = [32/(32+78)]x100 = 29,09 %
b3) n = 0,25/(0,25+1,0) = 0,20 b4) X = [0,25/(0,25+1,0)]x100 = 20 % (2,0 p)
b5) n(naftalin) = 0,20 Þ n(benzol) = 0,80
M(oldat) = (0,20x128 + 0,80x78)/(0,20+0,80) = 88,0 (0,75 p)
7. a) A színváltozás a narancssárgától zöldes-barnás árnyalaton át a sötétkék színig figyelhető meg; a változás 40o C-nál játszódik le leghamarabb; a 60o C és 80o C-os oldatnál később jelenik meg. (0,75 p)
A sötétkék szín megjelenése a 20o C-os oldatnál a leglassúbb és nem éri el a többi oldat színének intenzitását. (0,5 p)
Fokozatos lehűléssel jelenik meg a sötétkék szín, először a 60o C-os, majd a 80o C-os oldatok esetében. (0,5 p)
b) A bevezetőben említett enzim hatása miatt leghamarabb a 40o C-os oldatban látszik a színváltozás (sötétkék szín), mert az enzim leghatékonyabban 37o C-on működik. (0,5 p)
A magasabb hőmérsékletű oldatok esetében a H2O2 koncentráció nő a lehűléssel, ezért válik fokozatosan sötétkék színűvé. (0,5 p)
A 20o C-os oldat nem laboratóriumi körülmények között nem éri el a 37o C hőmérsékletet, ezért nem érheti el a maximális H2O2 koncentrációt (nem érte el az oldat az intenzív sötétkék színt). (0,75 p)
c) K2Cr2O7 ! 4H2O2 + H2SO4 ® 2CrO5 + 5H2O + K2SO4
vagy ionosan: Cr2O72- + 4H2O2 + 2H+ ® 2CrO5 + 5H2O (1,0 p)
- a színváltozásért felelős termék a CrO5 (peroxo-krómsav), amely vizes oldatban kék
színű); (0,5 p)
- a CrO5 színintenzitása a H2O2 mennyiségével arányos. (0,5 p)
8. a) (4,0 p)
8 |
24 |
13 |
15 |
14 |
16 |
11 |
15 |
19 |
||
11 |
1 A * |
7 ME |
3 TR |
8 TH |
4 AC |
6 OR |
2 TE |
5 HL |
9 AN |
16 |
20 |
5 HL |
9 AN |
6 OR |
2 TE |
1 T * |
3 TR |
8 TH |
4 AC |
7 AE |
19 |
14 |
2 PE |
8 TH |
4 AC |
5 HL |
9 AN |
7 AE |
1 T * |
6 OR |
3 NT |
10 |
23 |
8 TA |
6 GY |
9 * O |
4 * É |
3 ÍR |
2 ZS |
7 AN |
1 T * |
5 S * |
13 |
7 |
4 RE |
1 LD |
2 ÓS |
6 T * |
7 A * |
5 KE |
9 EM |
3 ZE |
8 CH |
20 |
15 |
7 EX |
3 IP |
5 BA |
9 AH |
8 TR |
1 IA |
4 AR |
2 I * |
6 N * |
12 |
6 |
3 ZE |
2 ÓS |
1 ÁL |
7 TE |
6 KI |
9 ED |
5 L * |
8 RJ |
4 RÜ |
17 |
22 |
9 ME |
5 LM |
8 K * |
3 AL |
2 N * |
4 KA |
6 AZ |
7 ZÁ |
1 TE |
14 |
17 |
6 LÉ |
4 * G |
7 KO |
1 RT |
5 YÚ |
8 NY |
3 EM |
9 AK |
2 * N |
14 |
18 |
11 |
16 |
11 |
13 |
21 |
14 |
24 |
7 |
b) „A tetrachlormethant, tetrachloraethant, pentachloraethant, a zsír és gyanta oldószereket a chemiai iparban extrahálószerül kiterjedten alkalmazzák, mert nem gyúlékonyak.” (2,5 p)
c) CCl4 ; C2H2Cl4 és C2HCl5 (0,75 p)
Extrahálás - laboratóriumi és vegyipari alapművelet, amely keverékeknek komponenseikre történő szétválasztására szolgál; a művelet során ún. szelektív oldószert használnak, amely általában a keveréknek csak egyik komponensét oldja (ritkábban több, de nem az összes komponenst oldja). (0,75 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
9. a) Gyümölcscukor (fruktóz), szőlőcukor (glükóz) és nádcukor (szacharóz); a nagy édességet a fruktóz adja. (1,0 p)
b) Az ember a gyümölcscukrot, a méhek pedig a nádcukrot érzik a legédesebbnek.(0,75 p)
c) A gyümölcscukor gátolja a kristályosodást, a szőlőcukor pedig gyorsítja ezt a folyamatot. (0,75 p)
d) A méz gyengén savas kémhatású. (0,25 p)
A mézben legtöbb az almasav = hidroxibutándisav: HOOC-CH(OH)-CH2-COOH
és a citromsav = 2-hidroxi-1,2,3-propántrikarbonsav:
HOOC-CH2-C(OH)(COOH)-CH2-COOH , valamint nagyon kevés hangyasav = metánsav: HCOOH. (Egyes mézekben szabad zsírsavakat is kimutattak.) (2,75 p)
e) A méz enyhén savas jellege miatt nem ajánlott a fémedényekben történő tárolása, mert a benne található savak a fémmel reagálhatnak és mérgező vegyületek keletkezhetnek. (1,0 p)
f) Mono-, di-, tri- és poliszacharidok, dextrinek, keményítők, aminosavak, fehérjék, enzimek, fermentumok, vitaminok, savak, aromaanyagok, színanyagok, ásványi sók.
(1,5 p)
g) A méhviasz kb. 300 féle különböző vegyületet tartalmaz; ezek: 35 % monoészter, 14 % diészter, 8 % hidroxi- és poliészter, 14 % szacharid, 12 % szabad zsírsav és 17 % egyéb alkotók. (2,0 p)