TAKÁCS CSABA KÉMIA EMLÉKVERSENY,
X. - XII. osztály, I. forduló - megoldás
2009 / 2010 –es tanév, XV. évfolyam
1. a) Sz. 1854; szerves kémiai katalízis és olajok hidrogénezése zsírokká; (0,2 p)
Kémiai Nobel-díj: 1912. (0,2 p)
b) Sz. 1807; antracén felfedezése; karbolsav azonosítása a fenollal; szerves gyökök elmélete. (0,4 p)
c) Sz. 1887; a rendszám felfedezése. (0,3 p)
d) Sz. 1837; a nem ideális gázok állapotegyenlete; intermolekuláris kölcsönhatás; elektrolitos disszociáció. (0,4 p)
Fizikai Nobel-díj, 1910. (0,2 p)
e) Sz. 1817; szénhidrogének szintézise (Würtz-reakció); szerves N-tartalmú vegyületek, szénhidrogének , glikolok vizsgálata. (0,3 p)
f) Sz. 1701; A „0” fokot a víz forráspontjához, 100 fokot a víz fagyáspontjához rendelte. (Ma ez éppen fordítva használatos!) (0,4 p)
g) Sz. 1852; a radióaktivitás felfedezője; Fizikai Nobel-díj: 1903. (0,4 p)
h) Sz. 1908; a radiokarbon kormeghatározás módszerének kidolgozója; (0,2 p)
Kémiai Nobel-díj: 1960. (0,2 p)
i) Sz. 1904; hozzájárult a molekulák és szabadgyökök geometriájának meghatározásához. Kémiai Nobel-díj: 1971. (0,4 p)
2. a) A Fülöp-szigeteken termő egyik kókuszdióban a n-heptán, C7H16 , fordul elő. (0,5 p)
b) Feltehetőleg a „petróleumdió” nevet azért kapta, mert a petróleumban előforduló egyik komponenst tartalmazza. A petróleumot elsősorban fűtésre használják és ennek megfelelően a petróleumdiót is erre használhatják a benne lévő heptán tartalma miatt (C7H16 - folyékony). (1,0 p)
3.
O.sz. /elem |
+6 |
+5 |
+4 |
+3 |
+2 |
+1 |
0 |
-1 |
-2 |
-3 |
-4 |
-5 |
-6 |
C |
CO2 |
(COOH)2 |
CO |
(CHO)2 |
CH2O |
C2H2 |
C2H4 |
C2H6 |
CH4 |
||||
N |
N2O5 |
NO2 |
N2O3 |
NO |
N2O |
NH2OH |
N2H4 |
NH3 |
|||||
S |
SO3 |
S2F10 |
SO2 |
H2S2O4 |
H2S2O3 |
S2Cl2 |
H2S2 |
H2S |
(25x0,15 = 3,75 p)
4. a) Az alkánokat fény jelenlétében klórozva (vagy brómozva) szubsztitúció történik. Monohalogén-származék Þ egy H-atom /molekula helyettesíthető egy halogénatommal/molekula.
Mivel csak egyetlen termék képződik, így a kiinduló alkán szimmetrikus szerkezetű kell legyen (=bármelyik C-atomon levő H-atom helyettesítésével azonos szerkezetű termék képződik). (1,0 p)
C(CH3)4 + Br2 ® C(CH3)3(CH2Br) + HBr ;
2,2-dimetil-propán = neopentán (0,75 p)
b) - magyarázat: lásd az a)-pontnál;
(H3C)3-C(CH3)3+ Cl2 ® (H3C)3-C(CH3)2-CH2Cl + HCl
2,2,3,3-tetrametil-bután (1,0 p)
c) - magyarázat: lásd az a)-pontnál; (0,25 p)
![]()
ciklopentán (0,75 p)
d) Az allilhelyzetű klórozás során a kettőskötésű C-atomok melletti telített C-atomon történik szubsztítúció . (0,5 p)
A Cl-tartalmú C-atomok rendűsége azonos Þ ezek a kiinduló szénhidrogénben is azonos rendűek kell legyenek. (0,25 p)
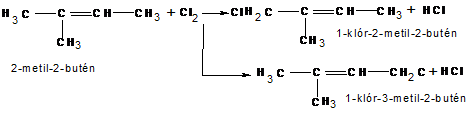
(0,25 + 2x0,75 p= 1,75 p)
e) Magyarázat: lásd a d).pontnál! (0,25 p)
Mivel egytlen termék keletkezik Þszimmetrikus szerkeze alkén kell legyen:
 (1,0
p)
(1,0
p)
f) A szénhidrogén szimmetrikus szerkezetű alkén kell legyen, mert a megadott reagens erélyes oxidálószer, amely elbontja a molekulát; mivel a termék csak 3 C-atomos, ezért nem elágazó az alkén szerkezete. (1,0 p)
CH3CH2CH=CHCH2CH3 + 4[O] ® 2CH3CH2COOH
3-hexén (0,75 p)
5. a) (6,25 p)
Vegyület neve vagy reakció |
Összevont szerkezeti képlet (vegyület vagy termék) |
Szigma- elektronok száma/ molekula |
pi- elektronok száma/ molekula |
Nemkötő elektron-párok száma / molekula |
(1) CH4 + 3Cl2 ® . . . . . |
CHCl3 0,1 |
8 0,25 |
0 0,1 |
9 0,3 |
(2) 2,2,4,6,6-pentametil- heptán |
C12H26 0,2 |
74 0,3 |
0 0,1 |
0 0,1 |
(3) propén enyhe oxidációja ® . . . . . |
CH2(OH)-CH(OH)-CH3 0,1 |
24 0,3 |
0 0,1 |
4 0,3 |
(4) kloroprén |
CH2=CCl-CH=CH2 0,3 |
18 0,3 |
4 0,3 |
3 0,3 |
(5) 1-butén allil-helyzetű klórozása ® . . . . . |
CH2=CH-CHCl-CH3 0,1 |
22 0,3 |
2 0,3 |
3 0,3 |
(6) 1,3-butadién + HOCl (1:1 mólarány) ® . . . . . |
ClCH2-CH=CH-CH2OH 0,1 |
24 0,3 |
2 0,3 |
5 0,3 |
(7) propén + ClF ® . . . . . (Magyarázat) |
ClCH2-CHF-CH3 0,1 |
20 0,3 |
0 0,1 |
6 0,3 |
b) (1) CH4 + 3Cl2 ® CHCl3 (kloroform) + 3HCl (0,6 p)
(3) H2C=CH-CH3 + [O] + H2O ® HOCH2-CH(OH) -CH3 (1,2-propándiol) (0,6 p)
(5) H2C=CH-CH2- CH3 + Cl2 ® H2C=CH-CHCl- CH3 + HCl (3-klór-1-butén) (0,6 p)
(6) H2C=CH-CH=CH2 + HOCl ® ClCH2-CH=CH-CH2OH (0,6 p)
1-klór-4hidroxi-2-butén vagy 1-klór-2-butén-4-ol (0,2 p)
(7) - a ClF - interhalogenid ugyanolyan poláris molekula, mint pl. a HCl, amely az aszimmetrikus alkének esetében a Markovnyikov szabály szerint addicionálódik: ClF - molekulában a F-atom a negatív pólus (legelektronegatívabb elem). (0,2 p)
H2C=CH-CH3 + ClF ® ClCH2-CHF-CH3 (1-klór-2-fluór-propán) (0,6 p)
6. a) Azonos hőmérsékletű, nyomású és térfogatú gázok azonos számú molekulákat tartalmaznak. (1,0 p)
(p1V1=n1RT1 és p2V2=n2RT2 ; p1=p2; V1=V2; T1=T2; Þ n1 = n2).
b) A száraz levegőben O2 és N2 molekulák találhatók, míg a nedves levegőben ezen kívül H2O(g) molekulák is vannak.
Az a)-válasz értelmében a (2)-es tartályban levő H2O molekulák bizonyos számú O2 és N2 molekula helyét foglalják el az (1)-es tartályhoz viszonyítva. (1,0 p)
M(H2O) < M(O2) és M(H2O) < M(N2) (1,5 p)
Így a száraz levegőt tartalmazó tartály tömege nagyobb. (0,5 p)
7. a) - az elegyet alkotó tagok: a1 >a2> a3 (0,25 p)
- a mértani sorozat összege: S3 = a1(0,253 - 1)/(0,25 - 1) = 1,312a1 (vagy:21a1/16) (0,75 p)
-az a1 értéke: a1 = 16S3/21 (0,25 p)
- az a2, a3 értékek meghatározhatók: an = a1qn-1 - ből:
a2 = (16S3/21)(0,25) = 4S3/21 és a3 = (16S3/21)(0,252) = S3/21 (0,5 p)
- az elegy tf.%-os összetétele: a1 = 76,16 %; a2 = 19,04 %; a3 = 4,76 % (1,25 p)
b) tf.%-os összetétel = mól-%-os összetétel (gázok esetében);
- az elegy átlagos moláris tömege: 32 = 16M1/21 + 4M2/21 + M3/21 (0,75 p)
- a 3 szénhidrogén egymás homológja Þ M3 = M1 + 28 és M2 = M1 + 14 Þ
M1 = 28; M2 = 42; M3 = 56 (1,0 p)
- a megfelelő szénhidrogének: CxHy
M1: C2H4 , etén; M2: C3H6 , propén; M3 = C4H8 , butén. (1,0 p)
c) - a butén polimerizációra képes izomerjeinek reakciói:
(1) n H2C=CH-CH2-CH3 ® [-CH2-CH(CH2CH3) -]n (0,5 p)
(2) n H3C-CH=-CH-CH3 ® [-CH(CH3) -CH(CH3) -]n (0,5 p)
(3) nH2C=C(CH3)2 ® [-CH2-C(CH3)2-]n (0,5 p)
8. a) A tölcsérben található polisztirol darabkák „ugrándoznak”. (0,5 p)
b) A reagáló anyagokból keletkezett CO2-gáz „dobja” a nagyon kis sűrűségű polisztirol darabokat: NaHCO3 + H3C-COOH ® H3C-COONa + H2O + CO2 (0,5+1,0 p)
c) Az általános szabály: az erősebb sav (bázis) kiűzi sójából a gyengébb savat (bázist).(0,5 p)
d) Szódabikarbóna. (0,25 p)
e) A szódabikarbónát az a)- és b)-pont jelenségei, folyamatai miatt a sütemények készítésénél használják, mivel a keletkezett CO2 „felfújja” (fellazítja) a tészta állagát (így lesz „könnyű” a sütemény). (1,0 p)
f) Pl. - citromot lehet a süteményben lévő NaHCO3-ra csepegtetni, mivel a citromsav is erősebb sav, mint a H2CO3, így kiűzi ez utóbbi savat sójából. (0,75 p)
9. a) (4,0 p)
•E |
3 ME |
9 NZ |
8 TI |
5 BA |
7 ŐS |
1 RI |
2 96 |
4 ID |
2 EK |
7 AS |
5 ZÁ |
1 • F |
4 LM |
9 K • |
3 S • |
6 • Ő |
8 T • |
4 GY |
8 KE |
1 ST |
2 (1 |
6 YE |
3 KU |
5 ÉR |
9 86 |
7 SZ |
7 AV |
4 ÉR |
3 T • |
6 ÉN |
9 NA |
5 N • |
8 LE |
1 CH |
2 ) • |
5 OL |
1 GU |
2 É • |
3 KÉ |
7 EL |
8 ÉP |
9 (1 |
4 • K |
6 • J |
8 ER |
9 BE |
6 DM |
4 KE |
2 82 |
1 ED |
7 ZÖ |
5 T • |
3 VE |
1 AU |
5 GO |
4 TÉ |
7 T • |
3 MI |
2 9 - |
6 T; |
8 TE |
9 5 ) |
3 NÉ |
6 RE |
8 ZE |
9 OL |
1 RI |
4 ÉL |
2 18 |
7 R • |
5 EL |
9 A • |
2 UL |
7 OL |
5 SÁ |
8 • K |
6 KE |
4 ET |
3 A • |
1 • K |
b) August Friedrich Kekulé (1829-1896) német kémikus a vegyértékelmélet kidolgozásában ért el eredményeket; Ő javasolt először szerkezeti képletet a benzolnak (1865). (1,0 p)
c) Kekulé megállap0totta, hogy a N három-, a C pedig négy vegyértékű; az alifás szénhidrogénekben a C-atomok láncot képeznek. Ő volt az, aki a szerves kémiát a C-vegyületek kémiájának definiálta. Előre látta a benzol diszubsztituált származékainak izomériáját. A benzolgyűrűben feltételezte a kettőskötések „állandó vándorlásait”. (1,5 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
10. a) A „párnák” alkalmazásakor a sót tartalmazó tégelyt el kell törni a zsákban, így ez
feloldódik avízben és a keletkezett oldat felmelegszik vagy lehűl (a só természetétől
függően). (1,0 p)
b) A CaCl2 melegítésre használt só, mivel az oldáshője: ΔH = – 82,8 kJ/mol; a negatív értékű ΔH exoterm (hőfelszabadulás) folyamatot jelöl.
Az NH4NO3 hűtésre használt só, mivel az oldáshője ΔH = 26,2 kJ/mol; a pozitív értékű ΔH endoterm (hőelnyelő) folyamatot jelöl. (2,0 p)
c) Egy mól anyag nagyon nagy mennyiségű oldószerben való feloldásakor felszabadult vagy elnyelt hőt moláris oldáshőnek nevezzük. (0,75 p)
11. a) Az 1850-es években csak a szerves trágyázás adott lehetőséget az asszimilálható N
bevitelére (a gazdaságok növényi és állati hulladékanyagainak felhasználása). (0,25 p)
1913 – ban, az ammónia előállításának felfedezése után, az ammóniumsóknak
műtrágyaként való előállítása forradalmasította a mezőgazdasági termelés hozamát.(0,5 p)
b) Az ammóniát (Haber – Bosch szintézissel) elemeiből állították elő (magas nyomás, katalizátor): N2 + 3H2 ® 2NH3 (0,75 p)
Az ammónia katalitikus oxidációja HNO3 – t eredményez:
NH3 + 2O2 ® HNO3 + H2O (1,0 p)
Az NH3 és HNO3 – ból keletkezett só a műtrágyában tovább növelte a N-tartalmat:
NH3 + HNO3 ® NH4NO3 (vagy: NH4OH + HNO3 ® NH4 + H2O ) (1,0 p)
c) o-C6H4(COOH)(HO) , o-hidroxi-benzoesav (0,5 p)
pl. C6H6 + H2SO4 ® C6H5 – SO3H + H2O
C6H5 – SO3H + NaOH ® C6H5 – SO3Na + H2O
C6H5 – SO3Na + NaOH ® C6H5 – OH + Na2SO3
C6H5 – OH + CH3Cl ® o-C6H4(OH)(CH3) + HCl
o-C6H4(OH)(CH3)+ 3/2O2 ® o-C6H4(COOH)(HO) + H2O (1,5 p)
(Megj. bármely más, helyes előállítás azonos pontértékű).
d) 1918 – ban készült el az első házi használatú hűtőszekrény. (0,25 p)
Freon-22: CCl2F2; diklór-difluor-metán. (0,5 p)
