TAKÁCS CSABA KÉMIA
EMLÉKVERSENY,
X.-XII. osztály, III.
forduló - megoldás
2009
/ 2010 –es tanév, XV. évfolyam
1. a) CH3CH2OH - etanol,
etilalkohol; H3C-O-CH3 - dimetiléter; (1,0 p)
b) Az etanol 78o C-on forr,
tehát standard körülményeken (25o C) folyékony.
A dimetiléter -24o C-on forr, tehát ennél magasabb hőmérsékleten, légköri
nyomáson gázállapotú. (2x0,75=1,5 p)
c) Az etanol
molekulák, az -OH - csoport jelenléte miatt hidrogén-híd kötéseket képesek létrehozni
(legerősebb intermolekuláris kapcsolat), míg a dimetiléter molekulái
között erre nincs lehetőség (ez utóbbiak a térszerkezetük miatt
apoláris molekulák). (1,5 p)
2.
|
a) |
b) |
c) |
d) |
|
a) C(CH3)4;
2,2-dimetil-propán; neopentán (0,75 p) |
b) ciklo-C6H12, ciklohexán-(szék forma) (0,5 p) |
c) HCºC-CH=CH2 1-butén-3-in vinil-acetilenid (0,5 p) |
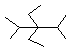
d)(CH2)C=C(CH2CH3)2 2-metil-3-etil-2-pentén (1,0 p) |
|
e)
|
f)
|
g) |
h)
|
|
e) C12H26 dodekán (0,5 p) |
f) C10H12 dekapentén (1,0 p) |
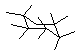
g) (CH3)2CH-C(C2H5)2-CH(CH3)2 2,4-dimetil-3,3-dietil-pentán (1,5 p) |
h) ciklo-C6(CH3)10 dekametil- ciklohexán (1,5 p) |
|
i)
|
j) |
k) |
l) |
|
i) ciklo-C6H7Br(CH3)4 2-bróm-1,1,3,3-tetrametil-ciklohexán (1,5 p) |
j) HOCH2CHOHCH2OH 1,2,3-trihidroxi-propán vagy 1,2,3-propántriol; glicerin (1,25 p) |
k)(CH3)2C=CH-(CH2)2- C(CH3)=CH(CH2)2- C(CH3)=CH –CH2OH 1-hidroxi-3,7,11-trimetil-2,6,10-dodekatrién ; farnezol (2,5 p) |
l) H2N-(CH2)6-NH2 hexametilén-diamin vagy 1,6-diamino-hexán (1,5 p) |
3. a) Oxidáció
= elektron leadás; redukció = elektron felvétel.
Mindazokban a reakciókban,
amelyben
pl. van elektron leadás, kötelező módon kell
legyen elektron felvétel is (és
fordítva),
mert a leadott elektronokat egy másik anyag részecskéi fel kell
vegyék. (1,5 p)
b) Nem „redoxi” folyamatok azok a kémiai reakciók,
amelyekben nem történik
oxidációszám
változás egyetlen elem esetében sem. Ezt úgy kell megállapítani,
hogy
megadjuk a folyamatban szereplő mindegyik
kémiai elem oxidációs számát az adott
összetételben és
amennyiben ezek elemenként nem változnak, akkor nem „redoxi” a
folyamat. (1,5 p)
Pl. Na+1O-2H+1 + H+1Cl-1 ® Na+1Cl-1 + H2+1O-2 (1,0 p)
4.
|
E-szám |
Vegyület neve |
Vegyület összevont képlete |
Adalékanyag hatása |
Élettani hatása (ahol van) |
|
210 |
benzoesav 0,1 p |
C6H5COOH 0,2 p |
tartósítószer 0,1 p |
allergiát, asztmát okozhat 0,2 p |
|
213 |
kalcium-benzoát 0,1 p |
(C6H5COO)2Ca 0,3 p |
tartósítószer 0,1 p |
allergiát, asztmát okozhat 0,2 p |
|
230 |
bifenil 0,1 p |
C6H5-C6H5 0,5 p |
tartósítószer 0,1 p |
citrusfélék héját kezelik vele penész
ellen; egészségkárosító hatású 0,2 p |
|
231 |
o-fenil-fenol 0,1 p |
o-C6H4(OH)-C6H5 0,5 p |
tartósítószer 0,1 p |
citrusfélék héját kezelik vele penész
ellen; egészségkárosító hatású 0,2 p |
|
236 |
hangyasav, metánsav 0,1 p |
HCOOH 0,25 p |
tartósítószer 0,1 p |
a szervezetben kis mennyiségben lebomlik,
nagy mennyiségben mérgező (patkányokban rákkeltő) 0,2 p |
|
239 |
hexametilén-tetramin 0,1 p |
(CH2)6N4 1,0 p |
tartósítószer 0,1 p |
a szervezetben káros formaldehiddé alakul 0,1 p |
|
260 |
ecetsav, etánsav 0,1 p |
CH3COOH 0,25 p |
étkezési sav, savanyúságot szabályozó 0,2 p |
irritáció 0,1 p |
|
263 |
kalciumacetát 0,1 p |
(CH3COO)2Ca 0,25 p |
tartósítószer, savanyúságot szabályozó,
stabilizátor 0,2 p |
--------------------- 0,05 p |
|
270 |
tejsav, (2-hidroxi-propánsav) 0,1 p |
CH3CH(OH)COOH 0,5 p |
étkezési sav, savanyúságot szabályozó 0,2 p |
irritáció 0,1 p |
|
280 |
propánsav (propionsav) 0,1 p |
CH3CH2COOH 0,25 p |
tartósítószer 0,1 p |
nagyobb mennyiségben elváltozást okoz
állatoknál 0,1 p |
5. a) r = M/Vm M(C3H8)
= 44 g/mol = 44 kg/kmol = 44 t/103kmol (0,5 p)
Vm
(0o C) = 22,4 dm3/mol = 22,4 m3/kmol =
22,4x103 m3/103kmol (0,5 p)
r (0o C) = (44 t/103kmol) / (22,4x103
m3/103kmol) = 0,00196 t/m3 (1,0 p)
Vm (25o C) =
24,45x103 m3/103kmol (0,5 p)
r (25o C) = (44 t/103kmol) / (24,45x103
m3/103kmol) = 0,0018 t/m3 (0,75p)
b) M(C3H8)
= 44 g/6x1023 db = 44x103 mg/6x1023 db = 7,33x10-20 mg/db (0,75 p)
V(C3H8)
(0o C) = 22,4x103 cm3/6x1023
db = 3,73x10-20 cm3/db
(0,75 p)
r (0o C) = (7,33x10-20 mg/db)/( 3,73x10-20 cm3/db) = 1,965 mg/cm3 (0,5 p)
V(C3H8)
(25o C) = 24,45x103 cm3/6x1023
db = 4,075x10-20 cm3/db (0,75 p)
r (25o C) = (7,33x10-20 mg/db)/( 4,075x10-20 cm3/db) = 1,798 mg/cm3 (0,5 p)
6. a) Az üvegben pezsgés figyelhető meg és a tölcsérbe
helyezett polisztirol darabkák
„ugrándozni” kezdenek. (1,0 p)
b) A NaHCO3 és ecetsav reakciójából felszabadult
CO2- gáz távozik a rendszerből és ez mozgásba hozza a
tölcsérben levő kis sűrűségű polisztirol darabokat:
(1,0 p)
NaHCO3
+ CH3COOH ® CH3COONa
+ H2O + CO2 (1,0 p)
c) Pl. Na2CO3
+ 2CH3COOH ® 2CH3COONa
+ H2O + CO2
vagy CaCO3 + CH3COOH ® (CH3COO)2 Ca + H2O +
CO2 stb. (1,5 p)
7. a) (2x3=6,0 p)
|
C6 |
9 |
4 |
R2 |
3 |
8 |
7 |
5 |
1 |
|
2 |
9 |
7 |
Q1 |
H8 |
S6 |
U5 |
4 |
3 |
|
A |
T |
E |
E |
K |
E |
E |
T |
A |
R |
A |
T |
T |
Á |
E |
C |
S |
G |
|
|
U5 |
Q1 |
2 |
9 |
6 |
7 |
3 |
8 |
G4 |
|
3 |
1 |
4 |
5 |
7 |
9 |
R2 |
6 |
8 |
|
I |
Z |
T |
É |
C |
J |
N |
R |
Z |
Y |
C |
K |
I |
D |
P |
R |
L |
N |
|
|
7 |
F3 |
8 |
4 |
5 |
A1 |
2 |
9 |
6 |
|
C6 |
8 |
5 |
2 |
G4 |
3 |
9 |
M1 |
7 |
|
E |
E |
E |
I |
N |
A |
O |
S |
I |
E |
O |
Ó |
A |
L |
A |
P |
S |
I |
|
|
3 |
W2 |
5 |
X7 |
1 |
6 |
D9 |
4 |
8 |
|
4 |
K7 |
8 |
6 |
J1 |
E5 |
3 |
2 |
9 |
|
K |
L |
O |
Z |
L |
E |
E |
K |
D |
Ó |
K |
L |
T |
I |
J |
Z |
U |
I |
|
|
4 |
8 |
6 |
N3 |
2 |
9 |
M1 |
7 |
5 |
|
A1 |
5 |
2 |
F3 |
9 |
P4 |
X7 |
8 |
B6 |
|
E |
J |
N |
I |
E |
O |
K |
É |
L |
N |
Á |
T |
E |
N |
R |
L |
A |
K |
|
|
1 |
7 |
9 |
5 |
O8 |
4 |
S6 |
2 |
3 |
|
D9 |
6 |
T3 |
7 |
2 |
8 |
4 |
5 |
1 |
|
É |
S |
L |
E |
E |
Z |
S |
F |
S |
T |
E |
T |
Ó |
A |
J |
R |
B |
Á |
|
|
2 |
4 |
J1 |
B6 |
7 |
E5 |
8 |
3 |
9 |
|
O8 |
3 |
6 |
9 |
L5 |
2 |
1 |
7 |
4 |
|
I |
A |
N |
K |
B |
U |
L |
N |
A |
O |
É |
Z |
Á |
Ó |
L |
L |
R |
E |
|
|
9 |
6 |
3 |
8 |
V4 |
2 |
L5 |
1 |
K7 |
|
7 |
I2 |
9 |
V4 |
6 |
1 |
8 |
3 |
5 |
|
J |
I |
E |
E |
L |
N |
M |
E |
Ő |
E |
H |
S |
A |
E |
Ó |
S |
N |
L |
|
|
H8 |
5 |
7 |
1 |
9 |
T3 |
P4 |
6 |
I2 |
|
5 |
4 |
1 |
8 |
N3 |
7 |
6 |
9 |
W2 |
|
N |
F |
L |
K |
A |
V |
A |
F |
E |
K |
K |
A |
T |
É |
T |
T |
Ú |
O |
b) Az alkéneket
olefineknek is nevezik. Ez a latin oleum faciens kifejezésből
ered, jelentése olajat csináló. Arra utal, hogy az etén és klór
reakciójából keletkezett diklóretán olajos tappintású. (1,0 p)
c) H2C=CH2
+ Cl2 ® ClH2C-CH2Cl 1,2-diklóretán (0,5 p)
d) Cl2HC-CH3 1,1-diklóretán (0,5 p)
e) Mindkét
esetben elsőrendű C-atomok vannak, mert a rendűség azt
jelenti, hogy az adott C-atom hány kötéssel kapcsolódik másik C-atomhoz.
(0,5 p)
f) 14 elektron kötésben és 12 elektron nincs kötésben (a molekulában található atomok vegyértékhéj
elektronjaiból). (0,5 p)
A két vegyület esetében a megnevezett
elektrontípusok száma megegyezik, mivel az atomok csak a molekulán
belüli helyzetükben különböznek, de a kialakult kötéstípusokban nem. (0,25 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
8. a) Szénhidrátok (=cukrok), fehérjék
olajok. (0,75 p)
b) Szénhidrátok
= cukrok = szacharidok: polihidroxi-karbonil vegyületek,
valamint ezek szubsztituált és polikondenzált származékai.
(0,5 p)
Fehérjék = aminokarbonsavakból felépülő
makromolekuláris vegyületek, amelyek az élő szervezet működését
meghatározó komponensek. (0,5 p)
Olajok = a
glicerinnek főleg telítetlen zsírsavakkal
képezett észterei. (0,5 p)
c) A második Világháború idején
tapasztalták érezhetően a kőolajhiányt és az 1970-es
években válságossá vált. (0,75 p)
9. a) metakrilsav: 2-metil-propénsav: H2C=C(CH3)-COOH (0,75 p)
b) magnézia: magnéziumoxid: MgO (0,3 p)
c) malátacukor:
maltóz
= két glükózmolekula összekapcsolódásából keletkezett diszacharid: C12H22O11 (0,75 p)
d) mannit:
hexahidroxihexán:
HOCH2(CHOH)4CH2OH (0,75 p)
e) mellitsav: benzol-hexakarbonsav: C6(COOH)6
(0,75 p)
f) mentol: 1-metil-3-hidroxi-4-izopropil-ciklohexán:
ciklo-C6H9(CH3)(OH)(CH(CH3)2) (1,20 p)
g) mínium: ólom(II)-ólom(IV)-oxid: Pb3O4
vagy 2PbO∙PbO2 (0,75 p)
h) allén: propadién:
H2C=C=CH2 (0,5 p)
i) sziksó: hidratált nátrium-karbonát, szóda, kristályszóda:
Na2CO3∙10H2O (0,5 p)
j) patina
(=nemesrozsda): bázisos-rézkarbonát: CuCO3∙Cu(OH)2 (0,75 p)