 (0,5
p)
(0,5
p)TAKÁCS CSABA KÉMIA EMLÉKVERSENY,
X. - XII. osztály, II. forduló - megoldás
2010 / 2011 –es tanév, XVI. évfolyam
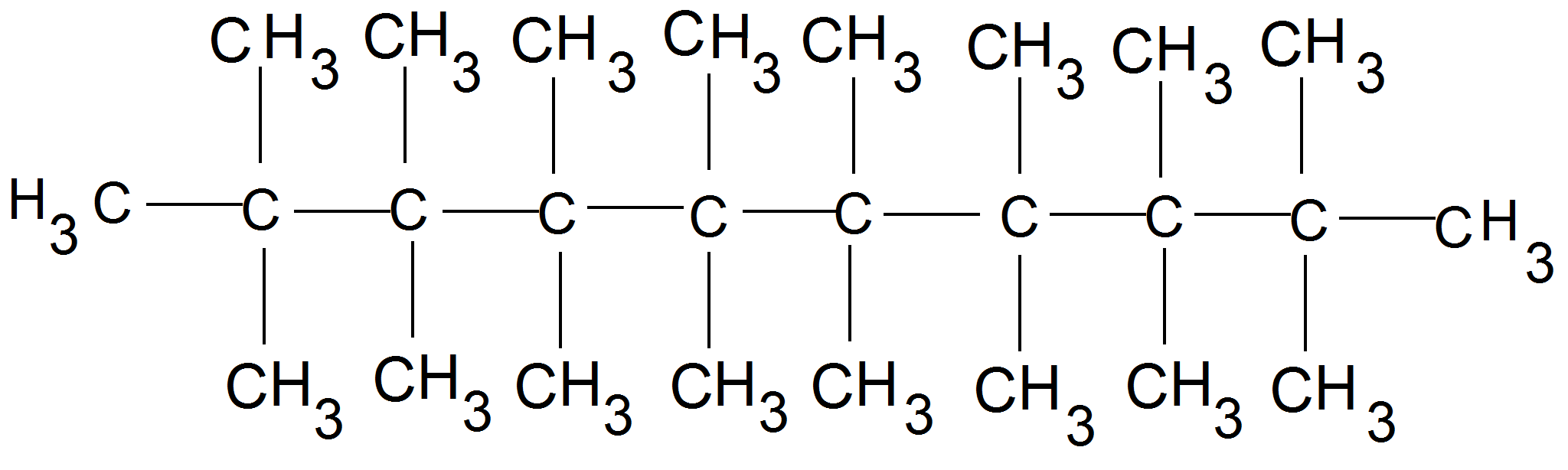
1. a)
 (0,5
p)
(0,5
p)
2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9-hexadekametil-dekán (1,25 p)
- összegképlet: C26H54 - hexakozán (0,5 p)
b) Az adott szerkezetű szénhidrogént nem lehet dehidrogénezni, mivel ez a folyamat feltételezi az egymás melletti C-atomokon található H-atomok távozását, amelynek eredményeként telítetlen termék keletkezhetne. Az adott szerkezetben nincs ilyen helyzet! (0,75 p)
Az egyetlen lehetőség a platformálási folyamat (=katalitikis reformálás), amelyben a dehidrogénezés során gyűrűs C-láncú termék keletkezhet!
Itt: 2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9-hexadekametil-ciklodekán lehet az egyik főtermék!
(1,5 p)
2. a) - 1 C-atomos olddaláncok száma: 6 db.; 2 C-atomos oldalláncok száma: 4 db.; 3 C-
atomos oldalláncok száma: 4 db.; 4 C-atomos oldalláncok száma: 4 db; (1,0 p)
- molekulaképlet: C53H108 (0,25 p)
6 db. 1 C-atom = 6 db. C-atom; 4 db. 2 C-atom = 8 db. C-atom
4 db. 3 C-atom = 12 db. C-atom; 4 db. 4 C-atom = 16 db. C-atom és
11 db. 1 C-atom a főláncban (1,25 p)
b) H2C=C(CH3)C(CH3)=C(CH3)C(CH3)=C(CH3)C(CH3)=CH2 (1,5 p)
2,3,4,5,6,7-hexametil-1,3,5,7oktatetraén (0,75 p)
c) H2C=C=C(CH3)C(CH3)2C(CH3)2C(CH3)=C=CH2 (1,5 p)
3,4,4,5,5,6-hexametil-1,2,6,7,-oktatetraén (0,75 p)
d) A b)- és c) -pont szénhidrogénjei nyílt C-láncúak és 4 „pi”-típusú kovalens kötést tartalmaznak ez a maximális nyílt C-láncú szénhidrogénekhez viszonyítva 4 H2 molekula (= 8 H-atom) „hiányát” jelenti; általános képlet: CnH2n6 . (0,75 p)
e) C14H22 (0,25 p)
f) diin két CC kötést kell tartalmazzon; (0,25 p)
- két tercier C-atom a CC kötések a lánc szélein kell legyenek, mert ha „beljebb” vannak, akkor már kvaterner C-aomonként vannak jelen a n-láncban; (0,5 p)
- egyetlen lehetséges szerkezet: HCC(CH2)10CCH (0,75 p)
- 1,13-tetradekatriín (0,25 p)
g) - mivel nincs primer C-atom, ezért a C=C kötések a C-lánc szélein kell legyenek;
- páronként konjugált helyzetű C=C kötés a C-lánc széleitől számított első és
harmadik C-atom után vannak; (0,75 p)
H2C=CHCH=CH(CH2)6CH=CHCH=CH2 (0,75 p)
1,3,11,13-tetradekatetraén (0,5 p)
3. a)
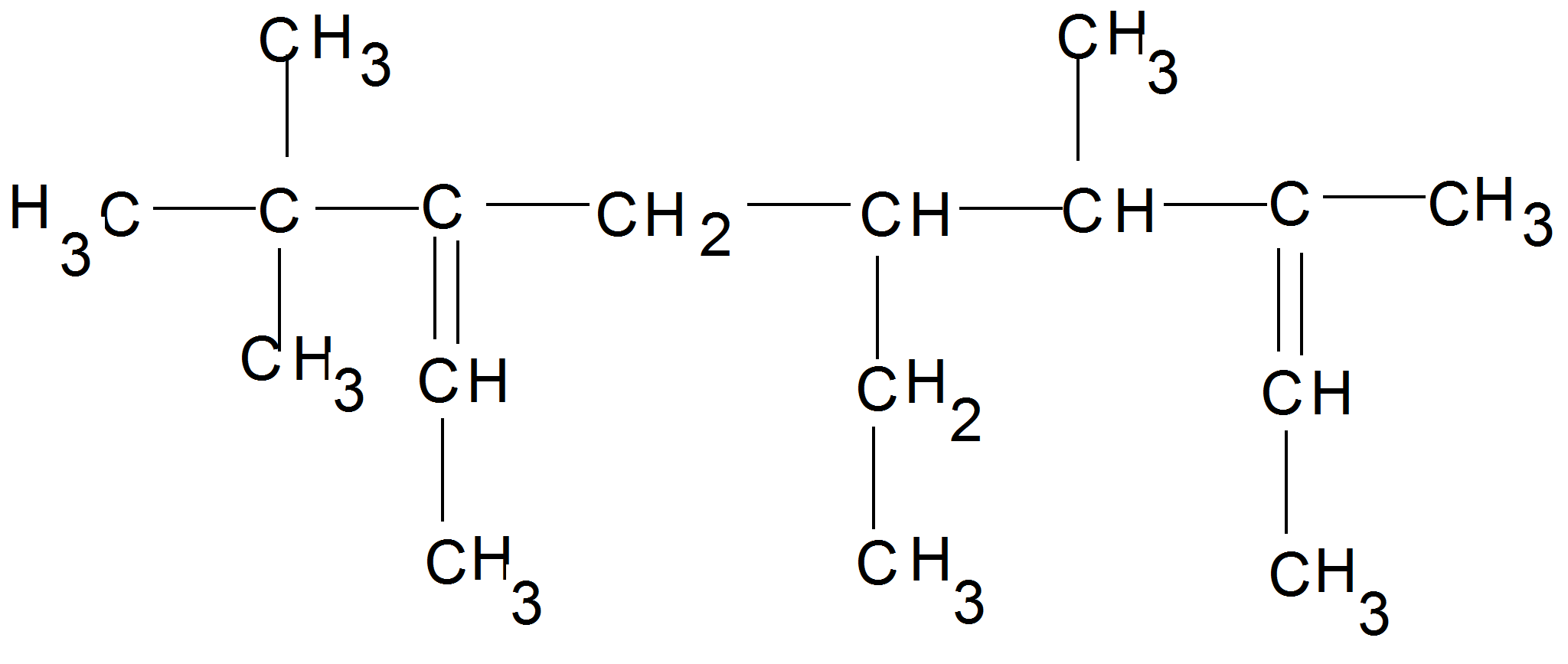 (0,75
p)
(0,75
p)
b) Az a)-pontban megadott elnevezés helytelen, mert a szénhidrogén a diének csoportjába tartozik, így a főlánc kell tartalmazza a két C=C kötést. A főlánc számozásának iránya az oldalláncokat tartalmazó C-atomok számainak összegétől függ: helyes irány az, ahol ez az összeg kisebb! (Az oldalláncok ábécé sorrendben következnek). (0,75 p)
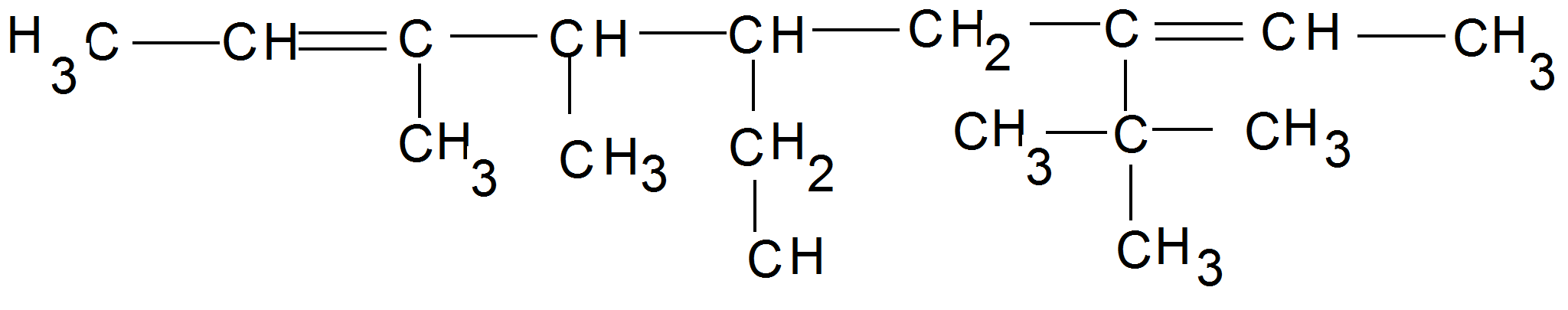 (0,25 p)
(0,25 p)
5-etil-3,4-dimetil-7-tercbutil-2,7-nónadién (0,75 p)
c) C17H32; ennek a szénhidrogénnek a T.Sz. = 2 általános képlet: CnH2n-2 (0,5 p)
- megfelelő szénhidrogéncsoportok:
(1) nyílt C-láncú diének; (2) nyílt C-láncú alkínek;
(3) dicikoloalkánok; (4) cikoloalkének (1,0 p)
4. a) CnH2n+2 (T.Sz. = 0) telített
(1) n-alkán: CH3CH2CH2CH2CH3 n-pentán (0,3 p)
(2) izoalkán: (CH3)2CHCH2CH3 2-metil-pentán
vagy: C(CH3)4 2,2-dimetil-propán (neopentán) (0,5 p)
b) CnH2n (T.Sz. = 1) lehetséges szerkezet: egy C=C kötés vagy egy telített gyűrű
(1) n-alkén: H2C=CHCH2CH2CH3 1-pentén
vagy: CH3CH=CHCH2CH3 2-pentén (0,5 p)
(2) izoalkének: H2C=C(CH3)CH2CH3 2-metil-1-butén
vagy: (H3C)2C=CHCH3 2-metil-2-butén
vagy: (H3C)2CHCH=CH2 3-metil-1-butén (0,5 p)
(3) cikloalkán:
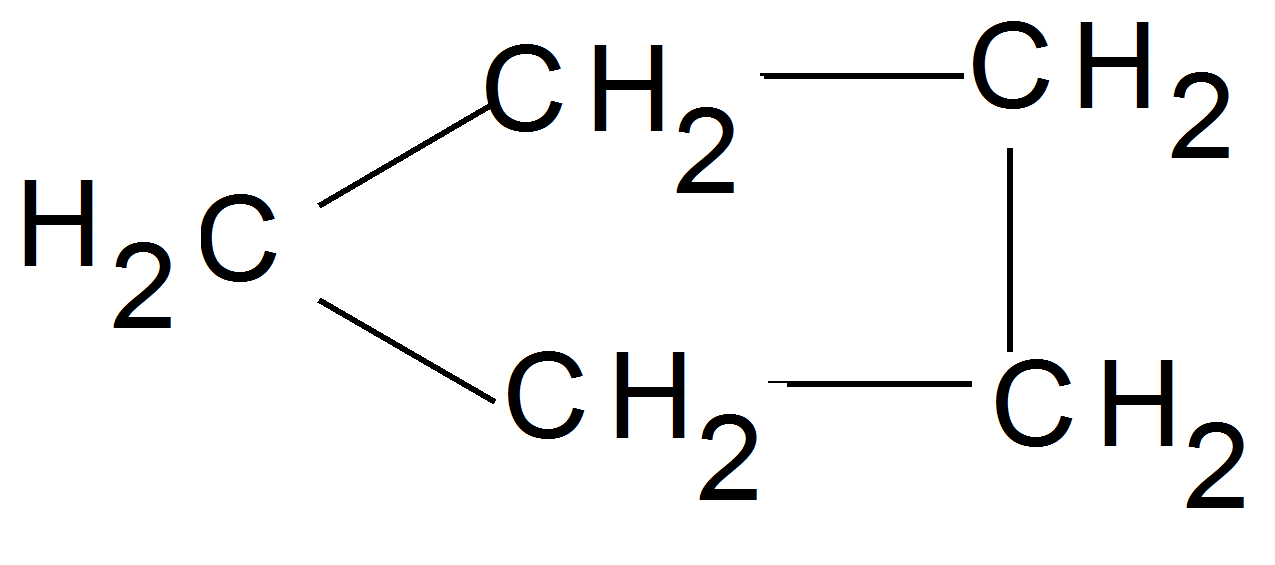 ciklopentán
(0,5 p)
ciklopentán
(0,5 p)
c) CnH2n-2 (T.Sz. = 2) lehetséges szerkezet: egy CC kötés; két C=C kötés; gyűrűs C=C kötés vagy két telített gyűrű
(1) n-alkin: HCCCH2CH2CH3 1-pentin
vagy: H3CCCCH2CH3 2-pentin (0,5 p)
(2) izoalkin: HCCCH(CH3)2 3-metil-1-butin (0,5 p)
(3) n-dién: 3 féle helyzeti izomér:
- kumulált dién: H2C=C=CHCH2CH3 1,2-pentadién (0,5 p)
- konjugált dién: H2C=CHCH=CHCH3 1,3-pentadién (0,5 p)
- izolált dién: H2C=CHCH2CH=CH2 1,4-pentadién (0,5 p)
(4) izodién: - kumulált: H2C=C=C(CH3)2 3-metil-1,2-butadién (0,6 p)
- konjugált: H2C=C(CH3)CH=CH2 2-metil-1,3-butadién (0,6 p)
(5) cikloalkén:
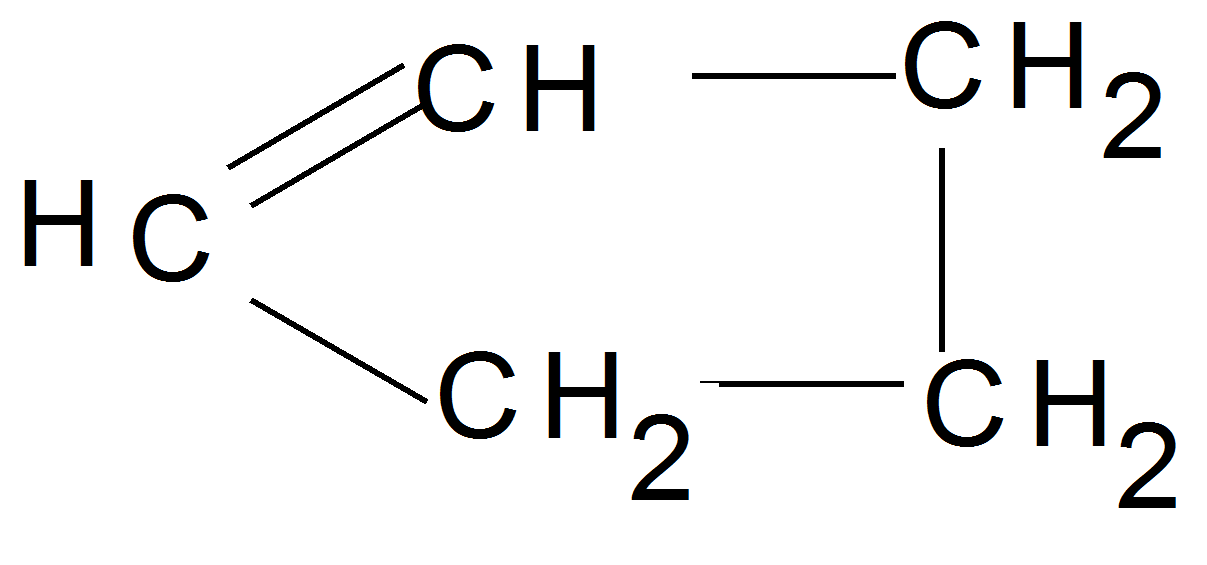 ciklopentén
(0,5 p)
ciklopentén
(0,5 p)
Megj.: a 4 és 3 C-atomos cikloalkén szerkezetek a nem megfelelő vegyértékszög miatt insatbilak; hasonló okok miatt instabilak az 5 C-atomos a két telített gyűrűből felírható szerkezetek is.
5. a) Az ózonpajzs elnevezés azért nem a legmegfelelőbb, mert az UV-sugárzás egy része
mindenképpen átjut rajta és eléri a földfelszínt. (0,5 p)
b) 1 dobson azt a légköri ózonmennyiséget fejezi ki, amely a földfelszíni körülmények között 0,01 mm vastag réteget alkotna. A szöveg szerint ez 150x0,01=15 mm vastagságú ózonréteget jelent. (0,75 p)
c) A kifejezés az ózon teljes hiányára utaló megnevezés, de valójában csak a réteg vastagságának csökkenéséről van szó. A jelenség időszakossága miatt sem szerencsés a kifejezés. (0,5 p)
d) Freonok; CFC (chloro-fluoro-carbon). (0,5 p)
e) Nagyon stabil vegyületek, ezért az atmoszférába változatlan összetétellel jutnak fel, ahol az UV sugárzás viszont már bontja őket olyan nagyon reakcióképes atomokra, amelyek az O3-molekulával reagálnak és azt bontják el. (1,0 p)
f) Freon-11: CFCl3 és freon-12: CF2Cl2
CFCl3CFCl2+Cl (1) Cl+O3O2+ClO (2) ClO+O32O2+Cl (3) (0,5+2x0,25 p)
CF2Cl2CF2Cl+Cl (1) Cl+O3O2+ClO (2) ClO+O32O2+Cl (3) (0,5+2x0,25 p)
6. a) Megj.: az adott körülményeken (200o C) a végbemenő reakciók minden komponense
gázhalmazállapotú térfogatarány = mólarány
- hidrogénezés: xCnC2n + xH2 xCnH2n+2 (0,75 p)
- égések: xCnH2n+2 + x(3n+1/2)O2 xnCO2 + x(n+1)H2O(g) (1,0 p)
(100-x)CnH2n + (100-x)3n/2 O2 (100-x)nCO2 + (100-x)nH2O(g) (1,0 p)
b) - kezdeti gázelegy égési reakciókban - egyenletek alapján:
x + x(1,5n + 0,5) + (100 - x) + (100 - x)1,5n = 0,5x + 150n + 100 (1,0 p)
- égés utáni gázelegy - egyenletek alapján:
xn + x(n + 1) + (100 - x)n + (100 - x)n = x + 200 (1,0 p)
- arányok: (0,5x + 150n + 100)/(x + 200) = 8800/10600 5300 = 850n + 17,5x (0,5 p)
n 2 és 0% < x < 100% kell legyen (0,25 p)
n = 2 nincs két egyenes C-láncú izomerje és x = 205,7 % - értelmetlen
n = 3 nincs két egyenes C-láncú izomerje és x = 157,14 % - értelmetlen n = 4 van két egyenes C-láncú izomerje és x = 108,57 % - értelmetlen
n = 5 van két egyenes C-láncú izomerje és x = 60 %
n = 6 három egyenes C-láncú izomerje van - nem lehet; x = 11,42 %
n = 7 több, mint két egyenes C-láncú izomerje van - nem lehet;
x =37,14 % - értelmetlen (1,5 p)
- alkén: C5H10 (0,25 p)
x = 60% alkén hidrogéneződött (0,25 p)
7. a) A polisztirol - nagyon enyhén poláris (gyakorlatilag apoláris) szénhidrogén monomérből
keletkezett polimer; az aceton szintén nagyon enyhén poláris (gyakorlatilag apoláris) molekulákból áll. A hasonló szerkezetű anyagok oldódnak egymásban. (1,5 p)
b) A polisztirol sok levegőt tartalmaz, ez növeli meg a térfogatát. Az oldandó anyag
tömege viszont kicsi, ezért képes kis mennyiségű oldószerben feloldódni. (0,75 p)
c) A polisztirol feloldódása után esetleg megmaradt oldószer hamar elpárolog, az oldott
anyagból és oldószerből keletkezett, megszilárdult „massza” megkötődik az üvegben.
(0,5 p)
8. a) (4,0 p)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 |
23 |
17 |
11 |
14 |
17 |
45 |
17 |
30 |
17 |
||||
|
|
14 |
4 BE |
2 KÉM |
8 BI |
6 |
1 ”A |
2 IÁB |
3 IE |
18 |
1 MIK |
9 AI |
6 KNE |
2 AN |
|
20 |
|
29 |
|||||||||||
|
26 |
7 FO |
6 KK |
4 TŰH |
9 JEL |
36 |
4 ÖZ, |
5 LN |
6 ELL |
1 OR |
2 MIN |
8 KÖR |
7 RMÁ |
3 GY |
|
|
45 |
||||||||||||
|
7 |
4 ÉS |
2 DIG |
1 KÉM |
37 |
9 NEK |
6 LE |
7 TLA |
8 ÜLM |
4 AM |
3 SZÓ |
12 |
8 ÉNY |
4 ELY |
|
|
38 |
9 |
|||||||||||
|
35 |
9 MI |
5 AGY |
7 NÍT |
8 NE |
6 NNI |
Idézet: Balázs Lóránt - |
29 |
7 JÁK |
4 ET, |
1 IAI |
9 NDE |
8 ML |
|
|
|
|
||||||||||||
|
|
29 |
8 ÁTS |
9 NE |
7 EL |
5 OBB |
23 |
9 LEM |
6 ÜK, |
8 ZIK |
|
|
||
|
17 |
12 |
39 |
6 |
||||||||||
|
12 |
9 LA |
3 RÖV |
16 |
9 TIN |
7 A |
|
22 |
9 NE |
8 TÚ |
5 RA |
14 |
9 VÉN |
5 KEL |
|
|
31 |
16 |
13 |
42 |
|||||||||
|
36 |
8 LSÁ |
1 AR |
7 NYO |
5 LÍ |
3 IDÍ |
4 HO |
6 ME |
2 VO |
15 |
7 MTA |
3 TÉS |
4 GY |
1 ÁNY |
|
|
|
||||||||||||
|
|
|
25 |
9 EK |
6 RT |
4 OLV |
2 LTA |
3 T, |
1 OKA |
24 |
9 KEZ |
8 GOS |
7 TOT |
|
|
9 |
22 |
45 |
6 |
||||||||||
|
28 |
6 EZE |
7 TK |
5 RNI |
3 MIN |
2 KJ |
1 TA |
4 ASH |
31 |
9 DŐB |
8 AN |
7 ÖNY |
6 KET |
1 KAR |
|
|
10 |
||||||||||||
|
6 |
1 UNK |
2 ELE |
3 TL |
17 |
8 FON |
9 ETŰ |
5 |
3 ERA |
2 K, |
20 |
9 JÉT |
8 TOS |
3 JZO |
|
|
45 |
6 |
26 |
||||||||||
|
18 |
2 DE |
5 A |
4 ATÓ |
6 KÖ |
1 KI |
34 |
3 LNI |
1 FEJ |
8 NAK |
9 FO |
6 NNY |
5 KÉ |
2 EDD |
|
|
4 |
||||||||||||
|
|
7 |
1 EZN |
2 IG |
4 LE |
21 |
3 EG |
1 I, |
2 IGE |
6 EBB |
5 MIA |
4 GYE |
|
|
|
3 |
|
39 |
4 |
||||||||||
|
10 |
2 NK |
4 N, |
1 SZÜ |
3 YÁ |
37 |
1 KSÉ |
2 EVÉ |
4 AS |
7 VET |
6 LE |
5 IJ |
9 GOM |
3 BRÁ |
|
|
22 |
||||||||||||
|
4 |
1 GÉT |
3 T, |
4 |
1 ÉR |
3 AME |
A kémia története c. könyv Bp.1996 |
3 |
1 EZZ |
2 SH |
3 |
2 ASZ |
1 ÜK |
|
|
|
8 |
|
15 |
||||||||||
|
|
|
6 |
3 LY |
2 NUK |
1 AK |
12 |
3 CSA |
1 ÉMI |
2 VO |
6 ÍRN |
|
||
|
25 |
30 |
23 |
6 |
||||||||||
|
35 |
6 I, |
8 |
5 ELE |
7 Á |
9 HA |
|
22 |
2 LT |
4 ZOK |
3 KK |
5 KNE |
7 MBÁ |
1 AI |
|
|
6 |
12 |
|||||||||||
|
16 |
7 RE |
9 SZN |
23 |
8 E |
2 KÖ |
1 JEL |
3 ISS |
4 ÁSO |
5 KB |
15 |
4 SB |
8 ZÉR |
3 ÉH |
|
|
8 |
3 |
|||||||||||
|
44 |
4 ETŰ |
6 ÉS |
2 NNY |
5 ETŰ |
7 ZU |
3 ASO |
8 TÉ |
9 ÁLN |
10 |
1 EKN |
3 NLÍ |
4 KNÉ |
2 EBB |
|
|
|
||||||||||||
|
30 |
8 NK |
7 TÓB |
6 NEM |
9 I” |
11 |
2 LE |
1 EK |
8 ÉMI |
6 |
2 ÍRN |
1 A |
3 TA |
|
|
|
|
|
|||||||||||
b) „Amikor kémiai arányokat akarunk kifejezni, szükségét érezzük a kémiai jeleknek. A kémiában mindig voltak jelek, de eddig igen kevés hasznuk volt. Könnyebb leírni egy szó rövidítést, mint lerajzolni egy ábrát, amely csak kissé hasonlít a betűhöz, és amelyet , hogy olvasható legyen, a szokásos betűknél nagyobbra kell írni. A kémiai jeleknek betűknek kell lenniük, mert ezeket könnyebb leírni, és nem formátlanítják el a nyomtatott könyvet. Ámbár ez utóbbi körülmény nem látszik túlságosan fontosnak… Ezért én kémiai jelnek minden elem latin nevének kezdőbetűjét fogom használni.” (1,5 p)
c) Jöns Jacob Berzelis svéd kémikustól: 1779-1848, származik a vegyjelek bevezetése.
(1,0 p)
d) Jeleket mindig használtak a kémiai folyamatok leírására, de ezek nem voltak egységesek; ábrákat már az alkimisták is használtak. Berzelius betűket javasolt a jelölésre, konkrétan az elem latin nevének kezdőbetűjét, így egységessé és mindenki számára érthetővé vált a kémiai folyamatok leírásának megértése. (1,25 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
9. a) Pl. HOH2C–CH(OH)–CH(OH)–CH=CH2 1,2,3-trihidroxi-4-pentén (1,25 p)
- egy C-atomon 2 vagy több OH-csoportot tartalmazó vegyületek instabilak, vízkilépéssel karbonil- vagy karboxi származékokká alakulnak; (0,5 p)
- telítetlen C-atomon levő OH-csoportú vegyületek szintén instabilak, amelyek tautomerizációval átalakulnak stabil vegyületekké. (0,5 p)
b) A benzol meggyújtva erősen kormozó lánggal ég nagy C-atomtartalma miatt!
M(C6H6) = 78 92,3 % C M(C6H12) = 84 85,71 % C (0,75 p)
c) C6H6 + 7,5O2 6CO2 + 3H2O C6H6 + 7,5O2 6CO2 + 3H2O (1,0 p)
d) R 11: Tűzveszélyes. (0,5 p)
R 23/24/25: Belélegezve, bőrrel érintkezve és lenyelve mérgező. (0,75 p)
R 45: Rákot okozhat (karcinogén hatású lehet). (0,5 p)
R 48: Hosszú időn át hatva súlyos egészségkárosodást okozhat. (0,5 p)
S 1/2: Elzárva és gyermekek számára hozzáférhetelen helyen tartandó. (0,5 p)
S 16: Gyújtóforrástól távol tartandó – Tilos a dohányzás. (0,5 p)
S 29: Csatornába engedni nem szabad. (0,5 p)
S 45: Baleset vagy rosszullét esetén azonnal orvost kell hívni. Ha lehetséges a címkét meg kell mutatni. (0,5 p)
S 53: Kerülni kell az expozíciót – használatához különös utasítás szükséges. (0,5 p)
e) R 38: Bőrizgató hatású. (0,25 p)
R 65: Lenyelve ártalmas, aspiráció (idegen anyagnak a légutakba beszívása) esetén tüdőkárosodást okozhat. (0,25 p)
R 67: Gőzei álmosságot vagy szédülést okozhatnak. (0,25 p)
S 25: Kerülni kell a szembejutást. (0,25 p)
S 62: Lenyelés esetén hánytatni tilos: azonnal orvoshoz kell fordulni és megmutatni az edényzetet vagy a címkét. (0,25 p)