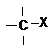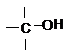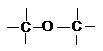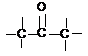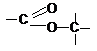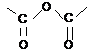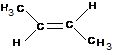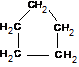X.-XII. osztály, IV. forduló - megoldás
2010 / 2011 –es tanév, XVI. évfolyam
1. a) Az alkánok telítettsége - maximális. (0,25 p)
Az alkánok azért maximális telítettségüeg, mert a C-atomok mind a 4 vegyértékükkel külön-külön kapcsolódnak 1-1 atomhoz. (0,5 p)
b) Az alkinek és cikloalkének telítetlenségi értéke - azonos (0,25 p)
Az a)-hoz viszonyítva mindkét vegyületcsoport 4 H-atommal kevesebbet tartalmaz, amelyek két elektronpárt „szabadítanak fel” és ez két telítetlenségi értéknek felel meg. (0,5 p)
c) Az arének standard állapotban folyékony és szilárd halmazállapotúak. (0,5 p)
Az anyagok halmazállapota standard körülményeken a molekulatömegtől és a molekulák szerkezetétől függ. A „leggönnyebb” arén molekulatömege is elég nagy ahhoz, hogy az adott körülményeken ne lehessen gázállapotú (C6H6 , M = 78) (0,75 p)
d) Az alkének klóraddíciója során vicinális helyzetű diklórszármazék keletkezik. (0,25 p)
Az addíció során egymás melletti atomokra (=vicinális helyzet) kerülnek a reagensek részei, mivel kettős vagy hármas kötést tartalmazó vegyületek sajátos reakciói. (0,5 p)
e) A metán a legnagyobb tömegszázalékos hidrogén tartalmú szénhidrogén. (0,25 p)
Az egyedüli szénhidrogén, amelyben 1 C-atomra 4 H-atom jut; 12g C + 4 g H = 16g Þ 25 tömegszázalék H.. (0,5 p)
f) 1 mol ciklooktatetraén és 1 mol sztirol teljes hidroghénezéséhez azonos mennyiségű H2-gázra van szükség. (0,25 p)
A ciklooktatetraénbeb négy C=C kötés található, a sztirolban szintén ennek megfelelő számú C=C kötés, amelyekből három a gyűrűben , egy pedig az oldalláncban van. (0,5 p)
g) A koronén atomszázalékos összetétele: 66,66 % C és 33,33 % H. (0,5 p)
A koronén (=hexabenz-benzol) összetétele: C24H12 Þ 36 atom/molekula; 2/3 C-atom és 1/3 H-atom. (0,75 p)
h) A trivinil-benzol és a butatrién molekulákban az atomszám-arány azonos. (0,25 p) Trivinil-benzol: C6H3(CH=CH2)3 Þ C12H12 és butatrién: H2C=C=C=CH2 Þ C4H4 (1,0 p)
i) 1 mol 1,3-butadién és 1 mol klór reakciója során izolált helyzetű diklórszármazék keletkezik. (0,25 p)
Az 1,3-butadién 1 mol reagenssel történő reakciója az ún. 1,4-es addíció szerint történik, amelynek során mindkét C=C kötés felszakad és a reagens részei az 1-es és 4-es C-atomhoz kapcsolódnak, miközben a 2-es és 3-as C-atomok között alakul ki C=C kötés.
(1,0 p)
j) Az izoprén és poliizoprén molekulák telítetlenségi értéke különböző. (0,25 p)
Az izoprén = 2-metil-butadién Þ két C=C kötést tartalmaz. Ennek polimerizációjával keletkezik a poliizoprén. A polimerizáció ún. 1,4-es addíció szerint történik, így a poliizoprén szerkezeti egységeiben egy C=C kötés marad! (1,0 p)
2.
|
a) |
b) -CºC- (0,25 p) alkin |
c)
(0,5 p) Konjugált alkadién
|
|
d) arén |
e) halogén |
f) Amino- |
|
g) hidroxi- |
h) éter- |
i)
aldehid |
|
j)
keton |
k)
karboxil- |
l)
észter- |
|
m)
amid- |
n) anhidrid- |
o)
savhalogenid- |
3.
|
Szén- hidrogén neve |
Mol- tömeg (g/mol) |
O.p. (oC) |
F.p. (oC) |
Halmaz-állapot (20 oC9 |
Szén- hidrogén neve |
Mol- tömeg (g/mol) |
O.p. (oC) |
F.p. (oC) |
Halmaz-állapot (20 oC) |
|
(1) etán |
30 (0,1) |
-183,2 (0,1) |
-88,6 (0,1) |
gáz (0,2) |
(6)transz-2-butén |
56 (0,1) |
-106,0 (0,1) |
1,0 (0,1) |
gáz (0,2) |
|
(2) hexán |
86 (0,1) |
-95,3 (0,1) |
68,7 (0,1) |
foly. (0,2) |
(7) ciklo-propán |
42 (0,1) |
-127,0 (0,1) |
-34,0 (0,1) |
gáz (0,2) |
|
(3) etén |
28 (0,1) |
-169,2 (0,1) |
-103,7 (0,1) |
gáz (0,2) |
(8) ciklo-bután |
56 (0,1) |
-90,06 (0,1) |
12,0 (0,1) |
gáz (0,2) |
|
(4) etin |
26 (0,1) |
-84,0 (0,1) |
-81,5 (0,1) |
gáz (0,2) |
(9) ciklo-pentán |
70 (0,1) |
-93,8 (0,1) |
49,0 (0,1) |
foly. (0,2) |
|
(5) cisz-2-butén |
56 (0,1) |
-139,0 (0,1) |
4,1 (0,1) |
gáz (0,2) |
(10)ciklo-hexán |
84 (0,1) |
6,5 (0,1) |
81,0 (0,1) |
foly. (0,2) |
a) A megadott vegyületek közül egyik sem lehet szilárd halmazállapotú, mert az o.p. értékeik nem érik el a 20oC-t. Mindazok a vegyületek, amelyeknek a f.p. értéke nem éri el a 20oC-t, azok 20oC-on gázhalmazállapotúak, amelyeknek a f.p. értéke 20oC fölött van, azok 20oC-on folyékony állapotúak. (1,0 p)
b) A transz módosulatok o.p.-ja mindig magasabb, mint a cisz módosulatoké. (Lásd a táblázatban az adatokat.) Ez arra vezethető vissza, hogy a transz módosulat molekulái az enyhén „nyújtott” téralkatuk miatt könnyebben alkothatnak kristályrácsot, mint a cisz módosulat nem „nyújtott” alkatú molekulái. Ezzel magyarázható, hogy a transz-izomérek kristályrácsának rácsenergiája nagyobb hőfokon bomlik fel. (1,5 p)
c) Az o.p. eltérések ebben az esetben a molekulák szerkezetének és polarításának következményei: a (4)-es molekula líneáris szerkezetű, míg a (3)-as molekula síkszerkezetű. A líneáris szerkezetű molekulák kristályrácsban (szilárd állapot) sokkal közelebb kerülhetnek egymáshoz, mint a sík szerkezetű molekulák és így eltávolításukhoz is több energia szükséges, amely a magasabb o.p. értékben nyilvánul meg. (1,0 p)
A fentieken kívül a (4)-es polarítása miatt a másodlagos vonzóerők is nagyobbak itt, mint a (3)-as apoláris molekulák között, ezért az előző molekulák eltávolítása több energiát igényel (nagyobb o.p.) (0,5 p)
4. a)
|
Gáz neve |
Molekulaképlet |
Moláris tömeg |
Forráspont (oC) |
|
metán (0,1) |
CH4 (0,1) |
16 (0,15) |
-161,5 (0,2) |
|
etán (0,1) |
C2H6 (0,1) |
30 (0,15) |
-88,6 (0,2) |
|
propán (0,1) |
C3H8 (0,1) |
44 (0,15) |
-42,1 (0,2) |
|
n-bután (0,1) |
C4H10 (0,1) |
58 (0,15) |
-0,5 (0,2) |
|
hélium (0,1) |
He (0,1) |
4 (0,15) |
-268,93 (0,2) |
b) -161,5o C-nál alacsonyabb hőmérsékletre kell lehűteni a földgázt ahhoz, hogy a benne lévő hélium gázállapotban maradjon és így el lehet vezetni. (Ez a He egyik legalkalmasabb ipari kitermelési eljárása). (1,0 p)
5. a) Kvarchomok = szilícium-dioxid; SiO2 (0,5 p)
b) Azok a „homokszemek” SiO2 összetételűek, amelyek tejfehérek vagy átlátszóak (a fekete,vörös, sárga vagy más színű szemcsék nem SiO2 tartalmúak). (0,75 p)
c) Mészkő, (CaCO3), szóda (Na2CO3•10H2O) és SiO2. (0,75 p)
d) 10 – 15% B2O3-t, illetve borszilikátot használnak. (0,25 p)
e) A golyóálló üvegeket műanyaggal megerősített üvegből készítik. A műanyagréteg nagyon vékony, de az összetört üveg rátapadva marad, így megakadályozza az üvegszilánkok szétszóródását. (0,75 p)
6. a) 2H2O (f) Û H3O+ +HO− (25oC) (0,25 p)
a1) – a hőmérséklet növekedése (endoterm folyamat) a vízmolekulák bomlásának kedvez, így a fenti egyensúly jobbra tolódik: (0,25 p) 2H2O (f) ® H3O+ +HO− (0,25 p)
- a vízmolekulákban található kovalens kötések felszakadását a hőenergia növelése segíti;
(0,5 p)
a2) - a hőmérséklet csökkenése (exoterm folyamat) nem kedvez a bomlási folyamatnak, így ez visszaszorul, az eredetileg megadott ionizációs folyamat egyensúlya balra tolódik:
2H2O (f) ¬ H3O+ +HO− (0,75 p)
b) az a1) folyamat a bomlásnak kedvez, így [H3O+] (25o C) < [H3O+] (t > 25o C), vagyis
[H3O+] > 10−7 lesz. (1,0 p)
- az a2) – ben a fentiek fordítottja valósul meg, így:
[H3O+] (25o C) > [H3O+] (t < 25o C), vagyis [H3O+] < 10−7 lesz. (0,75 p)
c1) Az előző válasz értelmében a felmelegített desztillált vízben [H3O+] > 10−7 Þ pH < 7 vagyis savas kellene legyen. Az [H3O+] – ionok koncentrációértéke helyes, de az a)-válaszban megadott bomlási folyamat értelmében [H3O+] = [HO−] és ezért a felmelegített desztillált víz is ugyanúgy semleges, mint a 25o C-os víz. (1,75 p)
c2) A lehűtött desztillált vízben [H3O+] < 10−7 Þ pH > 7, vagyis bázikus kellene legyen. Az előző válasz magyarázata itt is érvényes, tehát a lehűtött desztillált víz is ugyanolyan semleges, mint a 25o C-os víz. (1,0 p)
7. a) kb. 27 g cukor (1,0 p) b) kb. 45 – 50 g töltött csoki (1,0 p)
c) kb. 50 g tejcsoki (1,0 p) d) kb. 30 – 40 g keksz (1,0 )
e) Bármilyen b) -d) pontoktól eltérő megnevezett édesség lehet (1,0 p)
f) Bármilyen megnevezett rostos üdítő lehet. (1,0 )
g) Bármilyen megnevezett, és az előzőekben nem említett üdítő lehet. (1,0 p)
8. a)
|
|
1 |
3 |
2 |
8 |
9 |
7 |
5 |
6 |
4 |
||||||||||||||
|
|
· |
|
· |
|
A |
S |
|
|
O |
|
U |
Y |
|
|
E |
G |
|
||||||
|
8 |
9 |
4 |
5 |
6 |
1 |
7 |
2 |
3 |
|||||||||||||||
|
|
A |
|
R |
|
M |
|
I |
|
K |
|
· |
|
S |
|
· |
|
E |
||||||
|
6 |
7 |
5 |
2 |
4 |
3 |
1 |
9 |
8 |
|||||||||||||||
|
G |
|
|
Y |
|
A |
|
K |
|
M |
|
É |
|
K |
|
L |
|
Ü |
||||||
|
7 |
9 |
6 |
3 |
5 |
1 |
4 |
2 |
8 |
9 |
7 |
6 |
||||||||||||
|
K |
|
|
L |
|
S |
|
· |
|
Í |
|
A |
|
Z |
|
T |
|
E |
T |
|
|
O |
|
T |
|
5 |
2 |
3 |
4 |
8 |
7 |
6 |
1 |
9 |
3 |
5 |
2 |
||||||||||||
|
|
I |
|
T |
|
E |
|
K |
|
R |
|
É |
|
S |
|
E |
|
L |
N |
|
|
Í |
|
I |
|
8 |
1 |
4 |
9 |
2 |
6 |
3 |
7 |
5 |
8 |
4 |
1 |
||||||||||||
|
|
O |
E |
|
|
· |
|
L |
|
I |
|
S |
|
E |
|
S |
É |
|
|
T |
|
D |
|
· |
|
9 |
6 |
8 |
2 |
1 |
3 |
7 |
5 |
4 |
6 |
8 |
9 |
||||||||||||
|
|
− |
|
0 |
|
1 |
|
S |
|
E |
|
· |
|
K |
|
E |
Z |
|
|
· |
|
S |
|
E |
|
1 |
4 |
7 |
5 |
6 |
8 |
9 |
3 |
2 |
4 |
1 |
7 |
||||||||||||
|
|
A |
|
· |
|
1 |
|
É |
|
M |
|
A |
|
Z |
M |
|
|
E |
|
V |
I |
|
|
E |
|
3 |
5 |
2 |
7 |
4 |
9 |
1 |
8 |
6 |
2 |
3 |
5 |
||||||||||||
|
A |
|
|
2 |
· |
|
|
I |
|
K |
|
· |
|
N |
Ö |
|
|
T |
|
· |
É |
|
|
E |
|
4 |
7 |
9 |
8 |
3 |
2 |
5 |
6 |
1 |
(4,5 p) |
||||||||||||||
|
|
Y |
|
N |
K |
|
M |
|
|
R |
|
P |
|
A |
T |
|
|
O |
||||||
|
2 |
3 |
1 |
6 |
9 |
5 |
8 |
4 |
7 |
|||||||||||||||
|
|
É |
|
N |
|
M |
R |
|
|
S |
|
G |
|
T |
Z |
|
|
Á |
||||||
|
6 |
8 |
5 |
1 |
7 |
4 |
2 |
9 |
3 |
|||||||||||||||
|
I |
|
|
E |
E |
|
|
· |
|
A |
O |
|
|
R |
· |
|
|
O |
||||||
b) A Magyar Kémikusok Egyesülete iskola kísérletezéssel indította a 2011-es Kémia Nemzetközi Éve eseményeinek programsorozatát. (0,5 p)
c) 2011. január 26., 11 - 13 óra között. (0,5 p)
d) 285 iskola kapcsolódott be, ebből 12 romániai volt (6 helységből). (0,5 p)
e) „Vizet tűzzel - tüzet vízzel.” (0,5 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
9.
|
Név |
Síkképlet |
Képződéshő (kJ/mol) |
Név |
Síkképlet |
Képződéshő (kJ/mol) |
|
Etán |
H3C-CH3 (0,05) |
- 84,6 (0,15) |
Etén |
H2C=CH2 (0,05) |
52,6 (0,15) |
|
Etin |
HCºCH
(0,05) |
226,9
(0,15) |
Cisz-2-butén |
(0,1) |
-5,7
(0,15) |
|
Transz-2-butén |
(0,1) |
-10,1
(0,15) |
Ciklopropán |
(0,1) |
55,0
(0,15) |
|
Ciklobután |
(0,1) |
4,6
(0,15) |
Ciklopentán |
(0,1) |
-104,0
(0,15) |
|
Ciklohexán |
(0,1) |
-153,0
(0,15) |
|
||
a) A legkisebb képződéshő értékű két C-atomos szénhidrogén az etán (ez a legstabilabb). Az etén és etin kisebb stabilitásúak a bennük található pi-kötés miatt, amely gyenge kötés, így könnyen felszakad és a molekulák könnyen reagálnak. (0,5 p)
b) A képződéshő alapján a transz-2-butén a stabilabb. Ez egy olyan térben szimmetrikus szerkezet, amelyben a C=C kötés síkjához viszonyítva a nagyobb térigényű CH3-csoportok ellentétes térrészben találhatók és ezért a térben ezeknek a csoportoknak „van helyük”. (0,5 p)
c) A képződéshő értékei alapján a leginsatbilabb a ciklopropán és a legsatbilabb szerkezet a ciklohexán. A ciklopropán síkszerkezetű molekula, így a C-C vegyértékszög értéke 60o lehet, amely messze elmarad a C-C kötésnek megfelelő 109o28’ szögtől - (molekulán belüli feszültség lép fel), ezért ez a leginstabilabb cikloalkán. (0,5 p)
A ciklohexán molekula azért stabil, mert a 6 C-atomos gyűrű lehetővé teszi a C-C kötések 109o körüli értékeknek a kialakulását a térben (az ennél kevesebb C-atomos gyűrűs szerkezetben erre nincs lehetőség) - így létezhet az ún. „szék” és „kád” forma. (0,5 p)
10. a) BaSO4 - szuszpenzió (0,5 p)
b) A gyomor- és bélrendszer röntgenkészülékkel történő vizsgálatánál használják. (0,5 p)
c) A gyomor - és bélrendszer lágy szövet, nincs benne csont, így hiányzik a kalcium, amely megakadályozná a röntgensugarak útját. Ezért nem látható átvizsgáláskor az emésztőrendszer. A kalciumhoz hasonlóan a bárium is megállítja a röntgensugarakat. Ugyanakkor ez a vegyület a szervezetben nem reagál: oldékonysága nagyon kicsi [oldhatósági szorzat, L = 1,1x10-10 mol2/(dm3)2], így gyakorlatilag változatlan formában távozik a szervezetből (a gyomorsav = sósav sem oldja). (1,5 p)
d) A BaSO4 szervezetbe jutása nem teljesen biztonságos; oldhatósága ugyan nagyon kicsi, de az a kevés Ba2+-ion, amely szabaddá válik nagyon káros hatású. (1,5 p)
e) A BaSO4-szuszpenzióhoz hozzáadott MgSO4 csökkenti a Ba2+-ionok koncentrációját (amely nagyon mérgező). BaSO4(sz) Û Ba2+(aq) + SO42-(aq) egyensúly nagymértékben balra tolódott; a közös ion hatása ezt az egyensúlyt még jobban balra tolja el. A MgSO4-ból a SO42--ion a közös, így ennek jelenléte, a szabad Ba2+-ionok koncentrációját is csökkenti. (1,5 p)