TAKÁCS CSABA KÉMIA EMLÉKVERSENY,
IX. osztály, IV. forduló - megoldás
2010 / 2011 –es tanév, XVI. évfolyam
1. a) A térfogatos analízis egyik alapvető művelete, amely a mérőoldatnak a meghatározandó anyag oldatához történő adagolását jelenti. A titrálást a lejátszódó kémiai reakció befejeződéséig (=egyenértékpont) kell folytatni. Az eddig elfogyott (és a faktorral helyettesített) mérőoldat térfogatából kiszámítható a mért anyag mennyisége. (1,25 p)
b1) A Márá vize „keserű vala”, vagyis kesrű volt és ez a lúgos (=bázikus) oldatok jellemzője. (0,75 p)
b2) Mózes egy fadarabot dobott az ihatatlan (lúgos kémhatású) vízbe. A bibliai leírás szerint: és mutata néki az Úr egy fát és beveté azt a vízbe, és a víz megédesedék” – ez a fadarab valószínű semlegesítette a lúgos oldatot (=titrálta azt), így a keserű íz eltűnt, a víz pedig iható lett. Mind az élő, mind az elpusztult fák savasak (pl. a fűzfa szalicilsavat tartalmaz; a fa száraz ledpárlásával ecetsavat nyertek, tehát ezt a savat is tartalmazza; néhány fa levele és kérge a csersavat tartalmazza; az eépusztult fák megfakult és oxidálódott anyaga szintén savas, stb.) (2,0 p)
c) A megadott Bibliai idézet alkalimetriát jelent, mivel Mózes a „savas” fadarabbal a vizes oldat bázikus jellegét szüntette meg. (1,75 p)
A sav-bázis titrálást acidimetriának akkor nevezzük, ha savat kell meghatározni – addig kell adagolni az ismert koncentrációjú bázist, amíg a sav teljes mennyisége közömbösítődik. (1,5 p)
2. Fr2SO4 : francium-szulfát; (0,5 p)
A Fr alkálifém, amelyeknek általános jellemzője, hogy sóik vízben oldódnak. (0,75 p)
Ra3(PO4)2 : rádium-foszfát; (0,75 p)
A Ra az alkáliföldfémek csoportjába tartozik; ezeknek a foszfátjai nagyon rosszul oldódnak vízben (pl. a Ca-foszfát a csont összetevője), így nagy valószínűséggel a feltételezett vegyület is gyakorlatilag vízben oldhatatlan kell legyen. (1,25 p)
3.
|
|
Kijelentés |
Válasz |
Magyarázat/példák |
|
a) |
Atomjaikból csak kationok képződhetnek |
F (0,1) |
------------ |
|
b) |
Vegyületekben, egy kivétellel + és − oxidációs számmal is szerepelnek |
N
(0,1) |
Melyik a kivétel és miért? -a fluór a kivétel, amely a legelektronegatívabb elem, így csak „−” o.sz.-a lehet, ill. csak aniont képezhet (0,3) |
|
c) |
A főcsoportokban levők kevés vegyértékelektront tartalmaznak. |
F
(0,1) |
Mennyi ezeknek a lehetséges száma? 1, 2, 3, 4 és ritkán 5 (0,5) |
|
d) |
Van olyan elem, amely szobahőmérsékleten gázállapotú. |
N
(0,1) |
Melyek ezek? (Képlet/vegyjel) N2 ,O2 , F2 , Cl2 , He, Ne, Ar, Kr, Xe, (Rn) (1,0) |
|
e) |
Van olyan elem, amely szobahőmérsékleten folyékony. |
F + N (0,2) |
Melyek ezek? Br2 és Hg (0,2) |
|
f) |
Egyes képviselői molekularácsban kristályosodnak (megfelelő körülményeken). |
N (0,1) |
Minimum 2 példa! N2, S8, P4, I2, stb (0,3) |
|
g) |
Ionvegyületekben előfordulhatnak |
F + N
(0,2) |
Magyarázat! - ionvegyületek általános sajátossága: fém + nemfém, ill. kation + anion (0,3) |
|
h) |
Kivétel nélkül mindegyik képviselője vezeti az elektromos áramot. |
F
(0,1) |
Miért? - fémes kötés sajátosságai: a fématomok utolsó elektronhéjai vezetéksávot képeznek - az elektronok itt „szabadon” mozognak (0,75) |
|
i) |
Egyes képviselői színesek. |
F + N (0,2) |
------------ |
|
j) |
Van sárga színű képviselője is. |
F + N (0,2) |
Melyek ezek? - arany; kén (0,2) |
|
k) |
Vannak elemi állapotban is előforduló képviselői. |
F + N (0,2) |
Minimum 4 példa! - Au, Cu, O2 , N2 , stb (0,4) |
|
l) |
A d-mező elemei. |
F (0,1) |
------------ |
|
m) |
A p-mező elemei. |
F + N (0,2) |
------------ |
|
n) |
A periódusos rendszer főcsoportjaiban találhatók. |
F + N (0,2) |
------------ |
|
o) |
Egyes képviselői atomrácsban is kristályosodnak (megfelelő körülményeken). |
N (0,1) |
1 példa! - szén (0,1) |
4. a) Az elemi cella az a legkisebb szerkezeti egység, amelyből a tér három irányában történő ismételt eltolással felépíthető az egész kristályrács. (1,0 p)
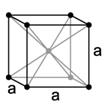
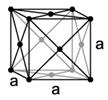
b) (1) egyszerű köbös (2) térben centrált köbös (3) lapon centrált köbös
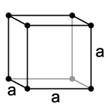
Az (1)-es cella csúcsaiban található részecskék nemcsak az ábrázolt cellához tartoznak, hanem mindegyik még másik hét cellának is része. Ezekből tehát egy cellára 1/8 – ad jut: ebben a cellában 8x1/8 = 1 db. részecske van. (1,25 p)
A (2)-es cella esetében az (1)-es cellához viszonyítva az eltérés egy részecske, amely a cella belselyében található és ez teljes egészében csak az illető elemi cellához tartozik. Ebben a cellában 8x1/8+1 = 2 db. részecske van. (1,75 p)
A (3)-as cella esetében az (1)-es cellához viszonyítva a kocka hat lapján található minden részecske még egy másik cellának is része. Ebben a cellában 8x1/8+6x1/2 = 4 db. részecske van. (2,25 p)
5.
|
|
Molekula-képlet |
Alkotó elemek rendszáma |
Molekula szerkezete |
Kötésben résztvevő elektronok száma |
A molekulá-ban elektro-nok számá-nak összege |
S pont |
|
a) |
HCl |
ZH= 1 ZCl=17 (0,1) |
H – Cl (0,15) |
2 (0,1) |
18 (0,1) |
(0,45) |
|
b) |
H2O |
ZH= 1 ZO = 8 (0,1) |
(0,15) |
4 (0,1) |
10 (0,1) |
(0,45) |
|
c) |
CH4 |
ZH= 1 ZC = 8 (0,1) |
|
8
(0,15) |
10
(0,1) |
(0,55) |
|
d) |
Cl2 |
ZCl= 17 ------ |
Cl – Cl (0,15) |
2 (0,1) |
34 (0,15) |
(0,40) |
|
e) |
CO2 |
ZC= 6 ZO = 8 ------ |
(0,25) |
8 (0,15) |
22 (0,15) |
(0,55) |
|
f) |
SO3 |
ZO= 8 ZS = 16 (0,1) |
|
12
(0,15) |
40
(0,2) |
(0,75) |
|
g) |
HNO3 |
ZH= 1 ZN = 7 ZO= 8 (0,1) |
|
12 (0,15) |
32 (0,15) |
(0,8) |
|
h) |
H2CO3 |
ZH= 1 ZC = 6 ZO= 8 ------ |
(0,4) |
12
(0,15) |
32
(0,15) |
(0,7) |
|
i) |
H2SO4 |
ZH= 1 ZS = 16 ZO= 8 ------ |
|
16 (0,2) |
50 (0,2) |
(1,0) |
6. a) Az EU-ban ütemtervet dolgoztak ki az alacsony CO2 – kibocsátású gazdaság 2050-ig történő megvalósítására. (0,5 p)
b) Az üvegházhatást (=globális felmelegedés) okozó gázok, főleg a CO2 mennyiségének visszaszorítására vonatkozik. (0,5 p)
c) 2050-ig 80-99 %-kal kívánják csökkenteni az üvegházhatást okozó károsanyag mennyiségét az 1990-es szinthez képest. Ehhez az szükséges, 2020-ig 20-25 %-kal, 2030-ig 40 %-kal, 2040-ig 60 %-kal csökkenjen a károsanyag-kibocsátás az 1990-hez képest. (2,0 p)
7. a) Cu + 2H2SO4 ® CuSO4 + 2H2O + SO2 (0,5 p)
b) A lehetséges két különböző kémiai összetételű termék: CuSO4 és CuSO4•5H2O
M(CuSO4) = 160 g/mol és M(CuSO4•5H2O) = 250 g/mol (0,75 p)
b1) 100 g CuSO4 előállításához szükséges:
1 mol = 160 g CuSO4 …………….. 1 mol Cu ………………….2 mol H2SO4
x1 = 0,625 mol Cu y1 = 1,25 mol H2SO4 (1,0 p)
b2) 100 g CuSO4•5H2O előállításához szükséges:
1 mol = 250 g CuSO4•5H2O4 …………….. 1 mol Cu ………………….2 mol H2SO4
X2 = 0,4 mol Cu y1 = 0,8 mol H2SO4 (1,5 p)
c) Az „elméletileg” kifejezés a kémiai átalakulások esetében arra vonatkozik, hogy a gyakorlatban elvégzett (ill. végbemenő) reakcióknál mindig van veszteség (az átalakulás soha nem 100 %-os). Ezért a kiinduló anyagok mennyiségéből számított termékmennyiség mindig kevesebb, mint amit a reakcióegyenlet alapján kiszámíthatunk. (1,75 p)
Ennek figyelembe vételével a b)-pontban számított kiinduló anyagmennyiségek valójában kisebbek mint, amit reálisan fel kell használni (a kiszámított anyagmennyiségeknél több kell ahhoz, hogy a megadott termékmennyiség keletkezzen). (0,75 p)
8. a) A tömény oldatból nagyobb méretű sókristályok válnak ki (nagyobbak, mint a feloldott kristályok). (0,5 p)
b) Nagy méretű sókristályok válnak ki. (0,5 p)
c) Ezek az oldatok sok, ill. maximális mennyiségű NaCl-t tartalmaznak, így a kristályosodás hamarabb megtörténik és nagyobb kristályok keletkezhetnek. (0,75 p)
d) Tiszta – azért, hogy a kristályosodást semmilyen szennyeződés ne befolyásolja, amely a kristály méretét is meghatározhatja. (0,25 p)
Lapos edény – a tömény oldat egyenletes eloszlását, valamint az oldószer fokozatos távozását is egyenletesen biztosítja, így a kivált kristályok méretei megközelítőleg azonosak. (0,5 p)
e) A kristályok kialakulása kikristályosodási folyamatban történik. A pamuttörlő lehetővé teszi az oldószer/víz párolgását és ugyanakkor megvédi az oldatot a portól, amely szennyeződésként kerülhetne be. (0,75 p)
f) A kristályosodási folyamat során csak akkor tudnak nagyobb méretű kristályok kiválni, ha az oldatban nyugalmi állapotban vannak (csak a vízmolekulák mozgása történik, de ezek segítik a víz elpárolgását). (0,75 p)
g) A meleg vízben jobban oldódik a konyhasó (tömény vagy telített oldat kell); az oldat lehűlése során ezekből hamarabb kiválnak a sókristályok. (0,5 p)
h) Ezzel az eljárással biztosítható, hogy a kristály ne érjen az oldatot tartalmazó edény falához, mert ez csökkentené a kristály növekedését és az alakját is befolyásolja. (0,5 p)
9. b) A 2011 év a Kémia Nemzetközi Éve, mert száz évvel ezelőtt kapott kémiai Nobel-díjat Maria Sklodowska-Curie és létrejött a Kémiai Szervezetek Nemzetközi Szövetsége. (0,8 p)
c) International Year of Chemistry. (0,25 p)
d) A KNÉ-ben javasolt kísérletsorozatok központi témája a víz. A szervezők ezzel azt szeretnék elérni, hogy minél több diák vizsgálja meg a környezetében előforduló vizek tulajdonságait. A végső cél: tudatosítani a kémia szerepét az emberiség egyik legfontosabb kincsének, a tiszta ivóvíznek az előállításában – ivóvíz nélkül az emberiség nem létezhet.
Tágabb értelemben a rendezvénysorozat üzenete: a kémia hasznosságának felismerése az emberi civilizáció fenntartásában. (1,3 p)
a)
|
4 |
2 |
7 |
8 |
9 |
6 |
1 |
5 |
3 |
(4,5 p) |
|||||
|
20 |
A |
É |
V |
• |
• |
• |
11 |
• |
||||||
|
7 |
3 |
1 |
6 |
8 |
9 |
2 |
4 |
5 |
||||||
|
A |
K |
A |
I |
• |
N |
• |
É |
M |
||||||
|
9 |
6 |
8 |
4 |
5 |
3 |
7 |
1 |
2 |
||||||
|
I |
K |
Z |
E |
T |
Z |
Ö |
E |
M |
||||||
|
1 |
5 |
6 |
3 |
7 |
2 |
8 |
9 |
4 |
||||||
|
• |
• |
M |
V |
E |
É |
R |
T |
E |
||||||
|
2 |
4 |
9 |
5 |
1 |
7 |
6 |
3 |
8 |
||||||
|
SZ |
Z |
L |
• |
• |
VV |
É |
Á |
E |
||||||
|
3 |
8 |
5 |
1 |
2 |
4 |
9 |
7 |
6 |
||||||
|
Z |
• |
L |
• |
E |
E |
|
TT |
Ő |
||||||
|
8 |
7 |
3 |
2 |
4 |
1 |
5 |
6 |
9 |
2 |
8 |
7 |
4 |
1 |
3 |
|
K |
• |
O |
P |
TT |
A |
S |
É |
• |
Í |
• |
T |
A |
D |
J |
|
6 |
9 |
2 |
7 |
3 |
5 |
4 |
8 |
1 |
6 |
9 |
3 |
7 |
2 |
5 |
|
A |
• |
É |
I |
M |
I |
T |
E |
Ö |
I |
• |
A |
A |
M |
R |
|
5 |
1 |
4 |
9 |
6 |
8 |
3 |
2 |
7 |
4 |
5 |
1 |
6 |
8 |
9 |
|
B |
N |
O |
− |
E |
L |
E |
V |
G |
K |
L |
S |
O |
D |
O |
|
|
7 |
5 |
8 |
3 |
2 |
4 |
9 |
6 |
1 |
|||||
|
U |
− |
R |
K |
S |
A |
I |
C |
W |
||||||
|
9 |
4 |
6 |
8 |
1 |
5 |
3 |
7 |
2 |
||||||
|
E |
• |
É |
R |
E |
L |
ÉS |
T |
• |
||||||
|
2 |
1 |
3 |
7 |
6 |
9 |
8 |
5 |
4 |
||||||
|
Ö |
J |
TT |
K |
• |
M |
É |
A |
• |
||||||
|
1 |
7 |
5 |
9 |
4 |
6 |
2 |
3 |
8 |
||||||
|
I |
R |
SZ |
E |
• |
E |
A |
I |
V |
||||||
|
6 |
9 |
2 |
1 |
3 |
8 |
5 |
4 |
7 |
||||||
|
• |
M |
E |
Z |
T |
E |
K |
E |
N |
||||||
|
8 |
3 |
4 |
5 |
7 |
2 |
1 |
9 |
|
||||||
|
• |
T |
K |
Ö |
I |
E |
Z |
SZ |
Z |
||||||