X.-XII. osztály, II. forduló, megoldás
2011 / 2012 –es tanév, XVII. évfolyam
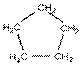
1. a)
|
(1) |
C13H28 |
C2H6 |
C8H18 |
C4H6 |
|
(1) |
C13H28 |
C2H6 |
C8H18 |
C5H10 |
|
(2) |
C8H14 |
C5H10 |
C2H2 |
C10H18 |
|
(2) |
C8H14 |
C4H6 |
C2H2 |
C10H18 |
|
(3) |
CaO |
Cr2O3 |
ZnO |
CdS |
|
(3) |
CaO |
Cr2O3 |
ZnO |
Fe2O3 |
|
(4) |
PbI2 |
NaBr |
Fe2O3 |
AlCl3 |
|
(4) |
PbI2 |
NaBr |
CdS |
AlCl3 |
(2,0 p)
b) Kakukktojások:
(1) C5H10 – amely az adott sorban cikloalkán lehet telített szénhidrogénként (ciklopentán);
(2) C2H2 – amely csak alkín lehet, míg a többi alkadiénként is felírható;
(3) CaO – főcsoport fémoxidja, a többi mellékcsoport fémoxidja;
(4) CdS – fémszulfid, a többi pedig fémhalogenid. (4,0 p)
(Bármilyen más helyes kakukktojás magyarázat azonos pontértékű!)
c)
d) H2C=C=CH–CH3 1,2-butadién H2C=CH–CH=CH2 1,3-butadién
HCºC–CH2–CH3 1-butin H3C–CºC–CH3 2-butin (2,4 p)
e) CaO: égetett mész; oltatlan mész; ZnO: cinkfehér, ill. cink-weiss (0,5 p)
2. (1) 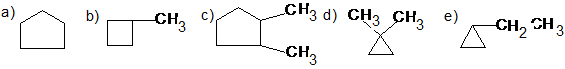
f) H2C=CH-CH2-CH2-CH3 g) H3C-CH=CH-CH2-CH3 h) H2C=C(CH3)-CH2-CH3
i) H2C=CH-CH(CH3)2 j) (H3C)2C=CH-CH3 (10x0,25 = 2,5 p)
(2) A b),d) és e) szerkezetek nem létezhetnek, mert az sp3-hibridállapotú C-atom vegyértékszöge 109o28’ kellene legyen, míg ezekben a szerkezetekben ennél kisebb
(b-ben 90o, a többiben 60o); így ezekben a molekulákban belső feszültség létezik, amely a molekula instabilitását okozza és a gyűrű felszakad - nyílt láncú telítetlen vegyületként stabilizálódik. (1,0 p)
(3)
|
|
a) |
b) |
c) |
d) |
e) |
f) |
g) |
h) |
i) |
j) |
|
p |
-- |
1 |
2 |
2 |
1 |
1 |
2 |
2 |
2 |
3 |
|
s |
5 |
3 |
3 |
2 |
3 |
3 |
1 |
2 |
1 |
-- |
|
t |
-- |
1 |
2 |
-- |
1 |
1 |
2 |
-- |
2 |
1 |
|
k |
-- |
-- |
-- |
1 |
-- |
-- |
-- |
1 |
-- |
1 |
(2,9 p)
3. a) H2C=C=CH-(CH2)3-CH3 1,2-heptadién (0,45 p)
b) H2C=CH-CH=CH-(CH2)2-CH3 1,3-heptadién (0,45 p)
c) H2C=CH-CH2-CH=CH-CH2-CH3 1,4.heptadién (0,45 p)
d) H2C=CH-(CH2)2-CH=CH-CH3 1,5-heptadién (0,45 p)
e) H2C=CH-(CH2)3-CH=CH2 1,6-heptadién (0,45 p)
f) H3C-CH=C=CH-(CH2)2-CH3 2,3-heptadién (0,45 p)
g) H3C-CH=CH-CH=CH-CH2-CH3 2,4-heptadién (0,45 p)
h) H3C-CH=CH-CH2-CH=CH-CH3 2,5-heptadién (0,45 p)
i) H3C-CH2-CH=C=CH-CH2-CH3 3,4-heptadién (0,45 p)
4. a) (1) H3C(CH3)6CH3 n-oktán (0,2 p)
(2) (CH3)2CH-CH(CH3)-CH(CH3)2 2,3,4-trimetil-pentán (0,6 p)
(3) H3C-C(CH3)2-C(CH3)2-CH3 2,2,3,3-tetrametil-bután (0,8 p)
b) (1) 2 db. primer + 6 db. szekunder C-atom (0,2 p)
(2) 5 db. primer + 3 db. tercier C-atom (0,3 p)
(3) 6 db. primer + 2 db. kvaterner C- atom (0,3 p)
5. a) - [CH2-CH(CN)]n- poli(akrilnitril) (0,75 p)
b) -[CH2-CH(O-CO-CH3)]n- poli(vinil-acetát) (1,0 p)
c) -[CH2-CH=CH-CH2]n-[CH2-CH(C6H5)]n- butadién-sztirol-kaucsuk (kopolimer) ;
- a megadott vonalképlet 1:1 mólarányú összetételt jelöl; (1,5 p)
d) -[CH2-CH=CH-CH2]n-[CH2-CH(CN)]n- butadién-akrilnitril-kaucsuk (kopolimer);
- a megadott vonalképlet 1:1 mólarányú összetételt jelöl; (1,5 p)
e)
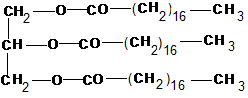 glicerin-trisztearát
(1,5 p)
glicerin-trisztearát
(1,5 p)
f)
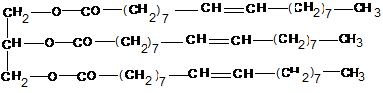
glicerin-trioleát (ill. glicerin cisz-trioleát) (2,0 p)
6. a) CnH2n + 3n/2 O2 ® nCO2 + nH2O (0,5 p)
- az adott hőmérsékleten minden komponens gázhalmazállapotú (0,25 p)
- feltételek szerint: p = állandó, T = állandó Þ V = állandó
- így: V(CnH2n) + 1,5nV(O2) + 4x1,5nV(N2) = nV(CO2) + nV(H2O) + 4x1,5nV(N2)
1 tf.CnH2n + 1,5n tf. O2 = n tf. CO2 + n tf. H2O Þ n = 2 (1,5 p)
- alkén: C2H4 etén (0,15 p)
b) (1) aCH4 + 2aO2 ® aCO2 + 2aH2O (2) bC2H4 + 3bO2 ® 2bCO2 + 2bH2O
(3) cC3H6 + 4,5cO2 ® 3cCO2 + 3cH2O (1,5 p)
- a kiinduló anyagok térfogata (1) - (3) reakciók alapján: a + b + c = 150 cm3 (A)
- az elfogyott levegő térfogata: (2a + 3b + 4,5c)5 = 2300 cm3 (B)
- a keletkezett CO2 térfogat: a + 2b + 3c = 300 cm3 (C)
- a fenti összefüggésekből: a = c és a = 20; b = 110; c = 20;
- tehát az eredeti keverék összetétele:
20 cm3 CH4; 110 cm 3 C2H4; 20 cm3 C3H6 (4,5 p)
7. a) A nagyobb kémcsőbe helyezett kisebb, lyukas kémcső tartalma (CaC2) érintkezik a vizes vattával Þ reakció megy végbe: CaC2 + 2H2O ® Ca(OH)2 + C2H2 (1,5 p)
b) Az üvegcső végéhez tartott égő gyújtópálca a durranógáz-próbát igazolja, vagyis a fejődő C2H2-gáz „hangeffektus” kíséretében elég: C2H2 + 5/2O2 ® 2CO2 + H2O (1,25 p)
c) A kisebbik kémcsőbe helyezett CaC2 csak így tud érintkezni a vízzel (vizes vattával), amely az C2H2 keletkezését biztosítja (lásd a)-válasz). (0,5 p)
8. a) (2,0 p)
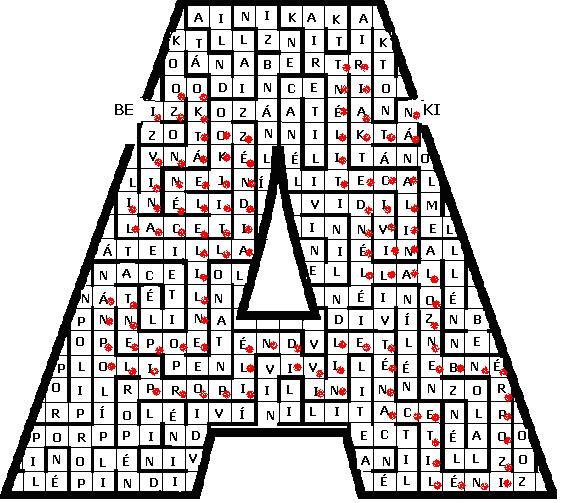
b) izooktán - vinilacetilén - ejkozén - diallil - neopentán - polipropilén - diviniletén - acetilén - izoprén - benzol - allén - divinilacetilén - triaktán (1,3 p)
c) (3. hely) - ejkozén: C20H40 (0,25 p)
(10. hely) - benzol: C6H6 (0,1 p)
(13. hely) - triaktán: C300H602 (0,35 p)
d) (2. hely): H2C=CH-CºCH (0,2 p)
(6. hely): -[H2C-CH(CH3)]n- (0,25 p)
(12. hely): H2C=CH-CºC-CH=CH2 (0,2 p)
e) (1. hely): (CH3)3C-CH2-CH(CH3)2 2,2,4-trimetil-pentán (0,5 p)
(4. hely): H2C=CH-CH2-CH2-CH=CH2 1,5-hexadién (0,5 p)
(5. hely): C(CH3)4 2,2-dimetil-propán (0,5 p)
(7. hely): H2C=CH-CH=CH-CH=CH2 1,3,5-hexatrién (0,5 p)
(8. hely): HCºCH etin (0,2 p)
(9. hely): H2C=C(CH3) -CH=CH2 2-metil-1,3-butadién (0,5 p)
(11. hely): H2C=C=CH2 propadién (0,5 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
9. a)-b) (1) H3C–CH2–HC*(CH3)–(CH2)3–CH3 3-metil-heptán (0,65 p)
(2) (H3C)2CH–C*H(CH3)–(CH2)2–CH3 2,3-dimetil-hexán (0,65 p)
(3) (H3C)2CH–CH2–C*H(CH3)–CH2–CH3 2,4-dimetil-hexán (0,65 p)
(4) H3C–CH2–C*H(CH3)–C*H(CH3)–CH2–CH3 3,4-dimetil-hexán (0,65 p)
(5) (H3C)3C–C*H(CH3)–CH2–CH3 2,2,3-trimetil-pentán (0,65 p)
c) A (4)-es: 3,4-dimetil-hexánnak van mezomódosulata is; ebben a szerkezetben két aszimmetrikus C-atom van, amelyeknek külön-külön azonos az összetétele, ezért mindössze 3 térszerkezet formájában írható fel, nem pedig 22 = 4 szerkezettel. Két szerkezet enantiomér párt képez (tárgy – tükörkép viszony), a harmadik pedig a mezomódosulat, amelyben a két C*-atom ellentétes térszerkezetű és molekulán belül kompenzálják egymást (optikailag inaktív). (1,5 p)
10. - kiindulás, pl. 100 g must Þ 23 g C6H12O6, amelyből X g átalakul erjedéskor; (0,35 p)
- az erjedési folyamat: C6H12O6 ® 2C2H5OH + 2CO2 (0,75 p)
M(C6H12O6) = 180 M(C2H5OH) = 46 M(CO2) = 44 (0,3 p)
- X g glükózból keletkezett termékek tömege:
m(alkohol) = 2x46X/180 = 0,511X g és m(CO2) = 2x44X/180 = 0,488X g (1,0 p)
- az erjedés után megmaradt elegy tömege:
(100 – 0,488X) g bor, az eltávozott CO2 gáz miatt (0,75 p)
- a keletkezett bor alkoholtartalma:
9(100 – 0,488X) = 100x0,511X X = 16,218 g glükóz bomlik (0,9 p)
- a borban megmaradt glükóz tömege: 23 – 16,218 = 6,782 g glüküz
- a keletkezett bor tömege: 100 – 0,488x16,218 = 92,086 g bor
- a keletkezett bor glükóztartalma:
m% glükóz = 100x6,782/92,086 = 7,36 % glükóz (1,2 p)