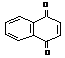X.-XII. osztály, IV. forduló, megoldás
2011 / 2012 –es tanév, XVII. évfolyam
1. a) - aromás éterizomerek:
 (0,25+0,2+3x0,15=0,9 p)
(0,25+0,2+3x0,15=0,9 p)
- aromás alkohol izomerek:
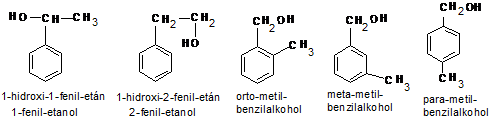 (5x0,3=1,5 p)
(5x0,3=1,5 p)
- fenol izomerek:

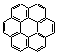
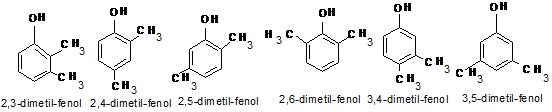 (2,7 p)
(2,7 p)
b) H3C-CH2-C(CH3)=C(CH3)-CH2-CH3 + 2[O] ® 2 CH3-CH2-CO-CH3 (0,75+0,3=1,05 p)
3,4-dimetil-3-hexén butanon (0,45 p)
c) H3C-CH=CH-CH=CH-CH3 2,4-hexadién szimmetrikus szerkezetű, ezért 3 geometriai izomér létezik: E,E-izomer; Z,Z-izomer és E,Z-izomer (ill. transz-transz; cisz-cisz és transz-cisz szerkezetek) a két C=C atomokhoz kapcsolt atomok/csoportok lehetséges térbeli elrendeződése miatt. (1,75 p)
d) - karbonilvegyületek:
H3C-CH2-CH2CHO butanal (butan-1-al); H3C-CO-CH2-CH3 2-butanon (etil-metil-keton);
(H3C)2CH-CH2CHO 2-metil-propanal (2-metil-propan-1-al) (0,5 p)
- stabil telítetlen alkoholok:
HO-CH2-CH=CH-CH3 2-butén-1-ol (1-hidroxi-2-butén) (0,3 p)
HO-CH2-CH2-CH=-CH2 3-butén-1-ol (1-hidroxi-3-butén) (0,3 p)
H3C-CH(OH)-CH=-CH2 3-butén-2-ol (2-hidroxi-3-butén) (0,3 p)
HO-CH2-C=(CH3)2 1-hidroxi-2-metil-2-propén (0,3 p)
- telítetlen éterek:
H3C-O-CH=CH-CH3 metil-1-propénil-éter (0,3 p)
H3C-O-CH2-CH=CH2 metil-allil-éter (0,3 p)
H2C=CH-O-CH2-CH3 etil-vinil-éter (0,3 p)
H3C-O-C(CH3)(CH=CH2) metil-izopropénil-éter (0,3 p)
2. (0,8,75 p)
|
S.sz. |
Anyag neve |
Képlet (0,25 p /képlet) |
Szín betűjele (0,1 p/szín) |
|
1. |
borostyánkősav |
HOOC-(CH2)2 -COOH |
f |
|
2. |
n-butanol |
H3C(CH2)3-OH |
d |
|
3. |
elaidinsav |
transz-HOOC-(CH2)7-CH=CH-(CH2)7-CH3 |
b |
|
4. |
glikol |
HO-CH2-CH2-OH |
d |
|
5. |
jodoform |
CHI3 |
b |
|
6. |
glicerin |
HO-CH2-CH(OH) -CH2-OH |
d |
|
7. |
kloroform |
CHCl3 |
d |
|
8. |
o-kinon |
|
a |
|
9. |
p-kinon |
|
b |
|
10. |
koronén |
|
b |
|
11. |
linolénsav |
H3C-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)7-COOH |
b |
|
12. |
mezitilén |
|
d |
|
13. |
mirisztinsav |
H3C(CH2)12-COOH |
d |
|
14. |
mustárgáz |
(Cl-CH2-CH2)2S |
d |
|
15. |
1,4-naftokinon |
|
b |
|
16. |
1,2-naftokinon |
|
a |
|
17. |
mirbánolaj |
|
b |
|
18. |
pikrinsav |
|
b |
|
19. |
pirogallol |
|
d |
|
20. |
piroszőlősav |
H3C-CO-COOH |
d |
|
21. |
ricinolsav |
H3C-(CH2)5-CH(OH) -CH2-CH=CH-(CH2)7-COOH |
b |
|
22. |
szalicilsav |
|
f |
|
23. |
szulfanilsav |
|
d |
|
24. |
trinitrobenzol |
|
b |
|
25. |
veratrol |
|
d |
3. a) NaN3 - nátriumazid; KNO3 - káliumnitrát; SiO2 - szilíciumdioxid (0,6 p)
- a NaN3 reakciója (b-pont) biztosítja a zsák felfújódását (0,15 p)
b) Az ütközéskor a gyújtó berendezésben keletkezett elektromos ív hatására a NaN3 bomlik:
2NaN3 ® 3N2 + 2Na + Q (1,25 p)
- a felszabaduló hő hatására a keletkező N2-gáz térfogata hirtelen megnő és ez fújja fel a légzsákot. (0,5 p)
- a keletkező nagyon reakcióképes Na redukálja a KNO3-t, amelynek során még szabadul fel N2-gáz: 10 Na + 2KNO3 ® K2O + 5Na2O + N2 (1,25 p)
- itt további reakcióképes vegyületek keletkeznek, az alkálifémoxidok, amelyek az adott hőmérsékleten a SiO2-dal viszonylag stabil vegyületeket képeznek (K- és Na-szilikát, az üveg fő komponensei): (0,5 p)
K2O + SiO2 ® K2SiO3 és Na2O + SiO2 ® Na2SiO3 (0,5 p)
c) A NaN3 színtelen, szagtalan, fehér kristályos vegyület. (0,15 p)
- szerkezet: Na+ -N=N+=N- (0,35 p)
- rendkívül mérgező, bőrön keresztül felszívódik; elpusztítja a baktériumokat, gombákat, állatokat és az embereket is. (0,5 p)
- kb. 50 mg káros az emberi szervezetre (kóma, vérnyomás csökkenés, szívritmuszavar, majd halál is bekövetkezhet) (0,25 p)
d) - a b)-válasz alapján a veszélyes NaN3 ártalmatlan vegyületekké alakul át, így az „elhasznált” légzsákokat tartalmazó autók a roncstelepre kerülve ebből a szempontból már nem jelentenek veszélyt; (1,0 p)
- a fentiekből következik, hogy a sértetlen légzsákot tartalmazó, roncstelepre került autók veszélyes hulladékot tartalmaznak, amely pl. a zsák sérülésekor kiszóródhat és a NaN3 vízzel HN3-t (hidrogén-azidot) eredményez, amely erős méreg; ez utóbbi a fémtárgyakkal robbanékony fémazidokká alakulhat. (1,5 p)
4. a) 50 g, 92%-os etanol oldatban: 46 g C2H5OH és 4 g H2O (0,75 p)
- a végbemenő reakciók:
C2H5OH + Na ® C2H5ONa + 1/2 H2 és H2O + Na ® NaOH + 1/2 H2 (0,75 p)
- az oldat etanol tartalmával reagált Na tömege: m = 23 g Na (0,5 p)
- az oldat víztartalmával reagált Na tömege: m = 4x23/18 = 5,11 g Na (0,75 p)
- összesen reagált Na tömege: m = 28,11 g Na (0,25 p)
m(Na, reagált) = m(Na, kocka) – m(Na, gömb) (0,25 p)
- legyen: r (cm) a Na gömb sugara; r = m/V összefüggésből:
m(Na, kocka) = r(2 r)3 és m(Na, gömb) = r (4p r3/3) (1,0 p)
m(Na, reagált) = r r3 5,645 = 5,475 r3 = 28,11 r3 = 5,13 cm3 (rNa=0,97 g/cm3) (0,75 p)
m(Na, kocka) = 39,80 g Na (0,25 p)
b) Gyakorlatilag azért nem mehet végbe, mert:
(1) – túl nagy a Na eredeti tömege az oldat tömegéhez képest;
(2) – az alkoholos oldat és a Na reakciója után megmaradt Na tömege:
m(Na, maradt) = 39,80 – 28,11 = 11,69 g Na nem reagál
- a Na reakciókészsége nagy, így a megmaradt Na a levegőn meg is gyulladhat; ez a reakció olyan heves (exoterm), hogy a kísérleti edényből az égő Na „kiszökhet”, útvonala nem határozható meg és ezért veszélyes lehet a közvetlen környezetére. (1,25 p)
5. a) Megnevezés, felhasznált anyagok, reakciókörülmények, megfigyelt jelenségek, stb. (3,0 p)
(A megnevezett kísérlet egyéni értékelése a fenti szempontok szerint!)
b) Miért volt ez a kísérlet számodra emlékezetes? (1,0 p)
(A megnevezett kísérlet egyéni értékelése a fenti szempontok szerint!)
c) A megnevezett kísérlet reakciók egyenletei! (1,5 p)
d) A megnevezett kísérletben tapasztalt jelenségek magyarázata! (1,5 p)
6.
a) (5,0 p)
|
|
· 3 |
H 7 |
C 5 |
Y 2 |
Á 4 |
T 6 |
Y 9 |
Y 8 |
P 1 |
|
||||||||||
|
Á 1 |
· 9 |
E 8 |
A 7 |
T 3 |
I 5 |
E 2 |
S 4 |
I 6 |
||||||||||||
|
· 6 |
N 2 |
· 4 |
· 8 |
L 1 |
G 9 |
Ö 3 |
Ó 5 |
M 7 |
||||||||||||
|
F 4 |
S 5 |
R 3 |
Y 1 |
O 7 |
G 2 |
T 6 |
L 9 |
A 8 |
||||||||||||
|
· 8 |
A 1 |
O 9 |
V 3 |
Ö 6 |
O 4 |
S 7 |
E 2 |
E 5 |
||||||||||||
|
· 7 |
R 6 |
· 2 |
B 9 |
B 5 |
N 8 |
G 4 |
F 1 |
É 3 |
||||||||||||
|
U 1 |
E 5 |
V 6 |
A 4 |
Á 9 |
Ö 8 |
E 2 |
N 3 |
I 7 |
L 4 |
V 8 |
T 1 |
S 5 |
E 6 |
L 9 |
E 8 |
L 2 |
M 4 |
P 7 |
Á 1 |
Y 3 |
|
E 2 |
E 3 |
Á 4 |
A 7 |
S 1 |
S 5 |
I 9 |
K 8 |
N 6 |
É 5 |
K 2 |
I 3 |
A 1 |
R 7 |
T 4 |
T 3 |
Y 6 |
S 9 |
V 8 |
T 2 |
G 5 |
|
· 9 |
Ő 8 |
I 7 |
R 2 |
T 6 |
, 3 |
· 5 |
· 4 |
· 1 |
· 6 |
F 9 |
· 7 |
· 8 |
B 3 |
O 2 |
F 7 |
S 1 |
É 5 |
M 6 |
É 4 |
E 9 |
|
C 8 |
L 2 |
O 1 |
S 5 |
S 4 |
E 6 |
E 7 |
L 9 |
E 3 |
|
· 4 |
M 9 |
· 5 |
G 6 |
V 3 |
J 7 |
R 1 |
O 8 |
I 2 |
||
|
J 6 |
E 9 |
H 5 |
E 3 |
T 2 |
L 7 |
F 4 |
Á 1 |
„2” 8 |
Z 3 |
N 1 |
Ő 7 |
Ő 5 |
· 8 |
O 2 |
E 4 |
L 9 |
Ó 6 |
|||
|
L 4 |
D 7 |
E 3 |
· 1 |
K 8 |
E 9 |
S 6 |
M 5 |
K 2 |
· 2 |
I 8 |
O 6 |
F 4 |
G 9 |
K 1 |
T 3 |
É 5 |
É 7 |
|||
|
S 7 |
I 1 |
E 9 |
L 6 |
T 3 |
E 4 |
B 8 |
D 2 |
R 5 |
D 9 |
E 3 |
· 7 |
T 6 |
D 4 |
D 1 |
I 2 |
S 5 |
· 3 |
É 9 |
K 7 |
O 8 |
|
É 5 |
E 4 |
S 2 |
C 8 |
Ö 7 |
O 1 |
A 3 |
A 6 |
S 9 |
L 1 |
S 2 |
Z 4 |
V 7 |
K 5 |
S 8 |
T 9 |
T 4 |
, 6 |
Z 2 |
Z 3 |
G 1 |
|
· 3 |
H 6 |
Á 8 |
· 9 |
L 5 |
O 2 |
O 1 |
E 7 |
E 4 |
O 6 |
E 5 |
T 8 |
O 9 |
C 2 |
A 3 |
Z 1 |
T 7 |
Á 8 |
T 5 |
G 6 |
· 4 |
|
|
K 9 |
T 1 |
S 8 |
· 5 |
A 4 |
I 2 |
K 3 |
K 7 |
Y 6 |
|
||||||||||
|
Á 2 |
· 4 |
T 3 |
, 8 |
E 7 |
· 6 |
A 1 |
O 9 |
K 5 |
||||||||||||
|
A 6 |
Ö 5 |
Z 7 |
I 3 |
Z 9 |
· 1 |
R 4 |
A 8 |
C 2 |
||||||||||||
|
Z 5 |
H 9 |
· 6 |
E 4 |
M 8 |
V 3 |
I 2 |
A 1 |
M 7 |
||||||||||||
|
É 7 |
E 8 |
· 1 |
Ó 2 |
R 6 |
A 9 |
Ö 5 |
I 3 |
A 4 |
||||||||||||
|
K 4 |
T 3 |
S 2 |
N 7 |
G 1 |
T 5 |
L 8 |
O 6 |
T 9 |
||||||||||||
b) „Pályafutása során kidolgozta a gyenge elektrolitok disszociációs törvényeit, bevezette az aktivitás fogalmát és felfedezte a reakciósebesség és hőmérséklet közötti törvényt. Megjósolta, hogy a rohamos ipari fejlődés következménye a növekvő CO2 kibocsátás, amely globális felmelegedést okozhat.” (1,5 p)
c) Svante Arrhenius, svéd kémikus, 1859 – 1927. (0,75 p)
d) 1903-ban az elektrolitos disszociáció törvényeinek kidolgozásáért. (0,5 p)
e) 1905 – ben. (0,25 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
7. a) A keserűsó: MgSO4; Glauber-só: Na2SO4; rézgálic: CuSO4 összetételűek (kristályvíz
nélkül). A permetezőszer hatóanyaga a Cu2+-ion, amely a d-mező eleme, és mint ilyen komplexképzésre hajlamos. Komplexet képezhet O-, N-tartalmú vegyületekkel, így a fehérjéket alkotó aminosavakkal is. Ezek a kapcsolatok a fehérjék denaturálódását eredményezik, vagyis irreverzibilis szerkezetváltozást, és így meggátolják a fehérjék biológiai funkcióinak ellátását. A Mg2+ - a Na+ - ionok, amelyek az s-mező elemei nem képesek komplexképzésre, így nem befolyásolják a fehérjék biológiai funkcióit. (2,5 p)
b) Az oldatok esetében az elektromos vezetés mértékét a jelenlévő ionok koncentrációja határozza meg.
(1) NaCl telített oldatban maximális az ionkoncentráció; a NaCl ionos vegyület, vízben oldódik és az adott oldatnak így maximális az elektromos vezető képessége. A hígítással csökken az ionok mol/dm3 – ben kifejezett koncentrációja és ugyanakkor nő a vízmolekulák száma, amelyek nem biztosítanak elektromos vezetést. (2,5 p)
(2) Az ecetsav gyenge sav, így vizes oldatban egyensúlyi disszociációs folyamat játszódik le: CH3COOH + H2O Û CH3COO- + H3O+ . A hígítással az egyensúly az ionképződés irányába tolódik el, ennek során nő a mol/dm3 –ben kifejezett ionkoncentráció és ezzel arányosan nő a hígított oldat elektromos vezetése. Az oldatnak ez a képessége akkor kezd csökkenni, amikor az elegyben található CH3COOH mind disszociáltak (ionizálódtak), és a további hígítás mértékével arányosan csökken az ionok koncentrációja és nő a vízmolekulák koncentrációja. (3,0 p)
c) A bontatlan üveg zárt rendszer, míg a felbontott üveg nyitott rendszer. Mindkét üvegben ugyanaz a reakció megy végbe: CO2 + H2O Û H2CO3 , de a rendszer állapotától függően más módon. A zárt rendszerben a fenti egyensúly dinamikus (= mindkét irányba azonos sebességgel megy végbe), míg a nyitott rendszerben a H2CO3 bomlásának irányába tolódik el, mert a felszabadult CO2 távozik a rendszerből. (2,0 p)