X.-XII. osztály, IV. forduló, megoldás
2012 / 2013 –ss tanév, XVIII. évfolyam
1. a) (1) C3H4 , propin; (2) C5H10 , pentén; (3) C4H6 , butin; (4) C6H10 , hexin;
(5) C20H38, ikozin; (6) C21H42 , henikozén; (7) C30H60 , triakontén; (8) C5H8 , pentin.
(4,0 p)
b) (1) –CH2–
; (2) –CH2–CH2– ; (3) ![]() (4)
(4) ![]()
(5) ![]() vagy
vagy 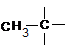 (1,5 p)
(1,5 p)
A megadott szerkezeteknek csak tájékoztató jellege van: a „=” és „º” jelek arra utalnak, hogy a megfelelő alkánból (paraffinból) hány H-atom hiányzik. A jelölés azért helytelen, mert mai értelmezés szerint kettős, illetve hármas kovalens kötés jelenlétére utalnak, ami nem létezik az alkán maradékokban. (1,0 p)
c) Az első tag megnevezése és az általános képlet alapján: CH2 . Ez nem létezhet (tehát nem is lehet előállítani), mert a C-atom 4 vegyértéke közül kettő szabad; ahhoz, hogy stabilizálódjon a szabad vegyértékekhez atomok kell kapcsolódjanak. (0,75 p)
d) (1) Az adott folyamatban a csapadék az AgCl lenne. A kloroform kovalens kötéseket tartalmazó vegyület, amelyeknek általános jellemzője (kevés kivételtől eltekintve, pl. savak), hogy nem disszociálnak vizes oldatban, így itt nem lesz szabad Cl- -ion. (1,0 p)
(2) CHCl3 + 4NaOH ®HCOONa + 3NaCl + 2H2O (1,0 p)
(3) CHCl3 + 3KOH + C2H5OH ® HCOOC2H5 + 3KCl + 2H2O (1,0 p)
A KCl10 azért csapódik ki, mert a jelenlévő anyagokban (CHCl3, alkohol, észter) nem oldódik. A keletkezett észter: hangyasav-etilészter vagy etil formiát. (0,75 p)
(4) 2CH3COONa + H2SO4 ® 2CH3COOH + Na2SO4 (0,5 p)
CH3COOH + CH3OH ÛCH3COOCH3 + H2O (0,5 p)
A kénsav kiűzi a gyengébb savat sójából, így válik szabaddá az ecetsav, amely gyengébb sav, mint a kénsav. A kénsav jelenléte az elegyben katalizálja az észterezési folyamatot. (0,75 p)
Észter: ecetsav-metilészter vagy metil-acetát. (0,25 p)
(5) CH3CH2OH + 4I2 + 6KOH ® CHI3 + HCOOK + 5KI + 5H2O (1,0 p)
A CHI3 sárga színű. Az adott körülmények között – híg oldatok használata – a víz fölöslegben lesz az elegyben és a CHI3 vízben oldhatatlan. (0,5 p)
2. a) NEM! II. évezred utolsó éve: 2000, ez szökőév Þ 366x24x60 = 527040 perc/év
- a szívdobbanások száma összesen: n = 527040x70x7x109 = 2,5825x1017 (1,0 p)
b) C15H32 ® 4,347x103 ; C20H42 ® 105 nagyságrendű az izomerek száma;
C25H52 ® 107 ; C30H62 ® 109 ; C35H72 ® 1011 ; C40H82 ® 1013 ; C45H92 ® 1015 ; C50H102 ® 1017 ; C55H112 ® 1019 ; C60H122 ® 1021 ; C65H132 ® 1023 ; (1,5 p)
(A valóságban a C63H128 –nak ®4,37672x1023 , a C64H130–nak 1,18462x1024 izomere van)
c) (NA)2 @ 6x1023 @ 1047 nagyságrend ; C70H142 ® 1025 ; C75H152 ® 1027 ; C80H162 ® 1029 ;
C85H172 ® 1031 ; C90H182 ® 1033 ; C95H182 ® 1035 ; C100H202 ® 1037 ; C105H212 ® 1039 ; C110H222 ® 1041 ; C115H232 ® 1043 ; C120H242 ® 1045 ; C125H252 ® 1047 ;
(A valóságban ennél kevesebb C-atomszámú alkánnak van 1047 izomere; pl. C110H222®1,46x1044 )
(0,75 p)
3. a) „Mindkettő”: AEÁ-ban, Kalifornia Államban, a San Francisco Öböl déli részén.(0,5 p)
b) Magyarul: „Szilíciumvölgy”. Ez a hely a szilícium alapú mikrocsipek gyártásának központja (volt). Angolul „Silicon Valley” = Szilíciumvölgy. Sajnos a „rossz fordítás” vezetett oda, hogy „Szilikon”-néven is nagyon gyakran emlegetik ezt a helyet. Angolul: silicon = Si). A magyar kémiai szaknyelven a „szilikon” megnevezés Si-tartalmú műanyagok csoportneve. (1,0 p)
c) -alapszerkezet:
-
általános képlet: ![]()
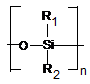 (0,75 p)
(0,75 p)
d) - a legegyszerűbb szilikonban R1 = R2 = –CH3 ; a leírt folyamatok reakcióegyenletei:
4CH3Cl + 2Si ® 2(CH3)2SiCl2 (CH3)2SiCl2 + 2H2O ® (CH3)2Si(OH)2 + 2HCl
n(CH3)2Si(OH)2 ® HO[(CH3)2SiO]nH + (n-1)H2O (1,5 p)
e) - Szövetbarát – ezért emberi szervezetbe beépíthető implantátumokat készítenek belőle;
- vízzel nem nedvesednek – szilikon olajok és zsírok formájában kenő- és tömítőanyagokat készítenek belőle; stb. (1,0 p)
4. a) A szódabikarbóna, NaHCO3, egy erős bázis (NaOH) és egy gyenge sav (H2CO3) sója, amely vizes közegben (itt: vízgőz, amely keletkezik a sütéskor) bázikus kémhatású. (Lásd a b-választ is.) A meggy színanyaga indikátor tulajdonságú, amelynek piros színe bázis hatására kékre változik. (1,5 p)
b) NaHCO3 + hő ® Na2CO3 ! CO2 + H2O(g) A keletkezett H2O(g) biztosítja a közeget a NaHCO3 és a belőle keletkezett Na2CO3 számára, amelyben megnyilvánul ezek bázikus hatása (lásd a-választ is). A CO2 pedig „felfújja” a tészta állagát. (1,5 p)
c) Pl. a lila színű „vörös”-káposzta pirosra színeződik, ha ecetes (=savas) salátát készítünk belőle. Hasonló jelenség tapasztalható a céklasaláta esetében is: a cékla eredeti sötét vörös színe élénk pirossá változik.
A málna-, eper-, meggyszörpöt vízzel hígítva és ehhez kevés szódabikarbónát (=bázis) téve buborékos üdítőital keletkezik, miközben az eredeti piros/vörös szín kékeslilára változik.
A „közönséges” tea jellegzetes barna színe kivilágosodik, a mélypiros gyümölcstea színe pedig élénk piros lesz a citromlé hozzáadása során. (1,5 p)
5.








1. Avogadro, teljes neve: Lorenzo Romano Amedeo Carlo De Markus Avogadro di Quaregna e di Cerreto, 1776 – 1856, olasz fizikus; a bélyegen található szöveg: „az azonos térfogatú, azonos hőmérsékletű és nyomású gázok azonos számú részecskét tartalmaznak” – 1811-ben publikálta a róla elnevezett törvényt; a bélyeget 1956-ban, halálának 100. évfordulójárta adták ki. (0,75p)
2. Sir Ernest Rutherford, 1871 – 1937, új-zélandi születésű, angol kémikus-fizikus; 1908-ban kémiai Nobel-díjat kapott a radioaktív bomlás törvényének felfedezéséért és a felezési idő fogalmának bevezetéséért. (0,75 p)
3. Justus von Liebig, 1803 – 1873, német kémikus, a mezőgazdasági kémia alapelveinek lefektetője. (0,75 p)
4. Kekulé von Stradonitz, Friedrich, 1829 – 1896, német kémikus, a benzol szerkezetének „megálmodója”. (0,75 p)
5. Müller Ferenc József, 1742 – 1825, osztrák származású erdélyi kémikus és minerológus. 1782-ben Erdélyben felfedezte a tellúrt (egyedüli elem, amelyet Románia mai területén fedeztek fel). (0,75 p)
6. Nagyrápolti Szent-Györgyi Albert, 1893 – 1986, magyar orvos-biokémikus. 1937-ben orvosi és élettani Nobel-díjat kapott „… a biológiai égésfolyamatok, különösképpen a C-vitamin és a fumársav-katalízis szerepének terén tett felfedezéséért.” (0,75 p)
7. Ferdinand Frederick Henri Moissan, 1852 – 1907, francia kémikus. 1906-ban kémiai Nobel-díjat kapott az elemi fluor előállításáért. (0,75 p)
8. Svante August Arrhenius, 1859 – 1927, svéd kémikus. 1903-ban kémiai Nobel-díj, az elektrolitos disszociáció elméletének kidolgozásáért. (0,75 p)
6. a) Vízben jól oldódó és az oldódás exoterm (hőtermelő) folyamat kell legyen. (0,5 p)
b) Zárt rendszerben mindkét anyag veszélytelen, ezért előnyösebb választani azt a vegyületet, amelyből azonos tömegre számítva több hő szabadul fel.
M(KOH) = 56; M(NaOH) = 40
56 g NaOH-ból felszabadult hőenergia: Q1 = 56x42,3/40 = 59,22 kJ
vagy: 40 g KOH-ból felszabadult hőenergia: Q2 = 40x53,5/56 = 38,21 kJ
vagy: 100 g KOH és 100 g NaOH-ból:
Q(100 g KOH) = 100x53,5/56 = 95,53 kJ/100 g KOH
Q(100 g NaOH) = 100x42,3/40 = 105,75 kJ/100 g NaOH
A NaOH-t előnyösebb használni. (1,25 p)
c) Eg(NaOH) = M/1 = 40 ; 20 N-os NaOH oldat = 20x Eg(NaOH)/1 dm3 = 800 g NaOH/1 dm3
moldat = rV = (1,54 kg/dm3)/1 dm3 = 1,54 kg = 1540 g oldat
mvíz = 1540 – 800 = 740 g víz
- oldhatóság = oldott anyag / 100 g víz
m(NaOH) = 800x100/740 = 108 g NaOH/100 g víz (1,75 p)
d) 10o C hőmérséklet emeléshez 10x4,18 = 41,8 kJ/kg szükséges
150 g étel/ital esetén: 150x41,8/1000= 6,27 kJ kell
m(NaOH) = 6,27x40/42,3 = 5,92 g NaOH
moldat = 5,92x208/108 = 11,40 g telített oldat (1,5 p)
e) A 11,4 g oldat akkor lenne elegendő, ha a hőfelhasználás kizárólag az étel felmelegítéséhez fordítódna 100 %-osan. A valóságban maga a töltet és az ételt tartalmazó edény is melegszik és hőkisugárzás is történik a rendszerből. (0,5 p)
7. a1) Rövid idő múlva a fehér barnás-fekete „kígyók” kezdenek kibújni és ezek egy ideig növekednek „fehér füst” kíséretében. Egy idő után a „kígyók” növekedése leáll, a „füst” megszűnik. Az alkohol égése: C2H5OH + 3O2 ® 2CO2 + 3H2O + Q
A felszabaduló hő hatására a szódabikarbóna elbomlik:
2NaHCO3 ® Na2CO3 + H2O + CO2 és a cukor bomlása = karamellizálódása is elkezdődik, majd elszenesedés, ha elegendő a hőenergia; ezt igazolja a barnás-fekete színű ” kígyók” megjelenése.
A cukor teljes bomlási folyamata: C12H22O11 ® 12C + 11H2O
A szódabikarbna bomlásából keletkező CO2-gáz „felpuffasztja” a bomlásnak induló cukrot – a „kígyó” növekedik. Ugyanakkor a CO2 és H2O.gőz keverékét látjuk fehér füstként. (2,5 p)
a2) Az a1)-kísérletben szagtalan termék keletkezik; itt ammónia – jellegzetes szúrós szag– keletkezése is észlelhető.
Az alkohol égéséből felszabadult hő itt a szalakálit bontja el!
NH4HCO3 ® NH3 + CO2 + H2O
A többi észlelt jelenség magyarázata és kémiai folyamatainak egyenlete megegyezik az a1)-válaszban megadottakkal (1,0 p)
b) Itt a bomlási folyamatokhoz szükséges hő a mikrohullámú sütő működése során keletkezik. A keletkezett képződmények szerteágazóbbak, mint az a)-ban, mert a hőenergia egyenletesebben oszlik meg a zárt rendszer miatt. (1,0 p)
8. a) (4,0 p)
|
7 |
5 |
2 |
3 |
1 |
4 |
9 |
6 |
8 |
|
Ő |
L |
Z |
L |
Z |
E |
É |
R |
K |
|
1 |
6 |
9 |
2 |
8 |
5 |
3 |
4 |
7 |
|
A |
S |
S |
Ü |
T |
T |
G |
Y |
· |
|
4 |
8 |
3 |
6 |
7 |
9 |
5 |
1 |
2 |
|
E |
· |
· |
E |
T |
· |
A |
M |
A |
|
8 |
9 |
4 |
1 |
2 |
3 |
6 |
7 |
5 |
|
K |
I |
U |
· |
A |
· |
I |
R |
G |
|
2 |
3 |
5 |
4 |
6 |
7 |
1 |
8 |
9 |
|
I |
K |
S |
K |
M |
I |
V |
O |
D |
|
6 |
7 |
1 |
5 |
9 |
8 |
2 |
3 |
4 |
|
· |
A |
M |
É |
· |
A |
I |
L |
Á |
|
9 |
2 |
7 |
8 |
3 |
6 |
4 |
5 |
1 |
|
N |
L |
N |
G |
É |
M |
Í |
T |
R |
|
3 |
4 |
8 |
9 |
5 |
1 |
7 |
2 |
6 |
|
M |
Á |
· |
Ö |
· |
E |
T |
Ö |
E |
|
5 |
1 |
6 |
7 |
4 |
2 |
8 |
9 |
3 |
|
B |
A |
A |
E |
T |
V |
T |
E |
K |
b) „Az első született magyar kémikus, aki a kémia világirodalmában nevét megörökítette.” (1,0 p)
c) Görgey Artúr (az 1848/1849-es szabadságharcban tábornok); 1818 – 1916. (0,5 p)
d) Görgey a zsírsavak elválasztásáról írt jelentős tanulmányt (Liebig Annalen, 1848). (0,5 p)
e) Zsírsavak: a növényi és állati eredetű zsírokból elszappanosítással (=lúgos hidrolzis) nyert alifás (telített és telítetlen) monokarbonsavak;
vagy: az összes alifás karbonsav, amely a természetben előforduló zsírsavakhoz hasonló tulajdonságú;
vagy: páros és nagy C-atomszámú, telített vagy telítetlen, egyenes C-láncú monokarbonsavak. (1,0 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
9. (1) H3C–C*HX–CH=CH2 2-halogén-3-butén (0,5 p)
(2) X2HC–C*H(CH3) –CH=CH2 1,1-dihalogén-2-metil-3-butén (0,5 p)
(3) XH2C–C*HX–CH=CH2 1,2-dihalogén-3-butén (0,5 p)
(4) H3C–C*H(OH)–CH=CH2 2-hidroxi-3-butén; (3-butén-2-ol) (0,5 p)
(5) (HO)H2C–C*H(HO)–CH=CH2 1,2-dihidroxi-3-butén; (3-butén-1,2-diol) (0,5 p)
(6) H5C6–C*H(HO)–CH=CH2 1-hidroxi-1-fenil-2-propén (0,5 p)
(7) HOC–C*H(CH3) –CH=CH2 2-metil-3-butenal (0,5 p)
(8) H3C–CO–C*H(CH3)–CH=CH2 3-metil-4-butén-2-on (0,5 p)
(9) HOOC–C*H(CH3)–CH=CH2 2-metil-3-buténsav (0,5 p)
(10) HOOC–C*H(CH3)–CH=CH–COOH 4-metil-2-penténdisav (0,5 p)
(11) HOOC–C*H(OH)–CH=CH2 2-hidroxi-buténsav (0,5 p)
(12) HOOC–C*H(NH2)–CH=CH2 2-amino-3-buténsav (0,5 p)
(Megjegyzés: a C* a szerkezetben levő aszimmetrikus C-atomot jelöli; van ahol más helyes
szerkezet is felírható a követelményeknek megfelelően.)
10. a) A telítetlen (C=C kötést tartalmazó) zsírsavakat (lásd 9.e választ is) nevezzük „omega” savaknak abban az esetben, amikor a C-lánc számozását nem a –COOH csoporttól, hanem az ellenkező végétől, a metil csoporttól kedve kezdjük. Az „omega” szó melleti szám azt jelöli, hogy a fentiekben megadott számozási sorrendben hányadik C-atomon kezdődik az első kettős kötés. (2,0 p)
b) (1) CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH omega-3
(2) CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH omega-6
(3) CH3(CH2)7CH=CH(CH2)7COOH omega-9
(4) CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH omega-6 (2,0 p)