X.-XII. osztály, I. forduló, megoldás
2013 / 2014 –es tanév, XIX. évfolyam
1. A) Plumbán = ólom(IV)-hidrid, PbH4; stannán = ón(IV)-hidrid, SnH4 . (1,5 p)
Mindkét vegyület molekulájában 4 H-atom található Pb-, illetve Sn-atomhoz kapcsolódva, amely az
alkánsorozat első képviselőjével, a metánnal (CH4) azonos atomaránynak felel meg. Erre
utal az „-án” végződés. Gázhalmazállapotúak. (1,0 p)
B) a) Vis-vitalis elmélet. (0,25 p)
b) Az „életerő” elmélet szerint az állati és növényi eredetű”szerves” vegyületeket csak az
élő szervezetek tudják előállítani az ún. „életerő” segítségével, amely kizárólag az élő
szervezetben léteziik és ezért csak ott fejtheti ki hatását. (1,0 p)
c) Wöhler, német vegyész döntötte meg az elméletet, aki szervetlen vegyületekből olyan
szerves vegyületet állított elő, amelyet addig csak élő szervezetből tudtak kivonni.(1,25 p)
C) a) (1,0 p)
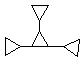
b) C12H18 TE = 4 (0,5 p)
c) A ciklopropán instabil gyűrű, mivel ebben a vegyértékszögek értéke csak 60o. Az sp3 hibridállapotú C-atom vegyértékszöge 109o28’ kellene legyen, ezért a gyűrűben feszültség lép fel és a ciklikus szerkezet felbomlik. (1,0 p)
D) TE = 1 Þ 1 gyuűrű vagy egy C=C kötés
![]()
![]()
ciklobután metil-ciklopropán
H2C=CH–CH2–CH3 H3C–CH=CH–CH3 H2C=CH(CH3)2
1-butén 2-butén izobutén / 2-metil propén
TE = 2 Þ 1 gyuűrű + egy C=C kötés; 2 db. C=C kötés; 1 db. CºC kötés
![]()
![]()
![]()
ciklobutén 2-metil-ciklopropén 1-metil-ciklopropén
H2C=CH–CH=CH2 H2C=C=CH–CH3 HCºC – CH2 – CH3 H3C–CºC–CH3
1,3-butadién 1,2-butadién 1-butin 2-butin
TE = 3 Þ 1 gyűrű + 2 db. C=C kötés; 1 gyűrű + 1 db. CºC kötés; 3 db. C=C kötés;
1 db. C=C kötés + 1 db. CºC kötés
![]()
![]()
![]()
![]()
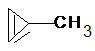
ciklo-1,2-butadién ciklo-1,3-butadién ciklobutin metil-ciklopropin metilciklopropadién
H2C=C=C=CH2 H2C=CH–CºCH
butatrién vinil-acetilén / but-1-in-3-én
TE = 4 Þ 1 gyűrű + 3 db. C=C kötés; 1 gyűrű +1 db.C=C +1 db. CºC kötés;
2 db. 1 db. CºC kötés (más szerkezeti lehetőségre itt nincs elég C-atom):
![]() HCºC–CºCH összesen:22 szerkezet (pontozva:
20x0,125=2,5 p)
HCºC–CºCH összesen:22 szerkezet (pontozva:
20x0,125=2,5 p)
Ciklobutatrién 1,3-butadiin
E) C4H6 alkadién közvetlen homológjai: C3H4 és C5H8
H2C=C=CH2 propatrién (0,2 p) H2C=C=CH–CH2–CH3 1,2-pentadién (0,3 p)
H2C=CH–CH=CH–CH3 1,3-pentadién (0,3 p)
H2C=CH–CH2–CH=CH2 1,4-pentadién (0,3 p)
H3C–CH=C=CH–CH3 2,3-pentadién (0,3 p)
H2C=C(CH3)–CH=CH2 2-metil-1,3-butadién (0,3 p)
H2C=C=C(CH3)2 3-metil-1,2-butadién (0,3 p)
F) a) H2C=CH–CH2–CH3 –[H2C – CH(C2H5)]n– poli(1-butilén) (0,55 p)
b) H2C=C(CH3)2 –[H2C – C(CH3)2]n– poli(izobutilén) (0,85 p)
c) H2C=C(CH3)–CH=CH2 –[H2C–C(CH3)=CH–CH2]n– poliizoprén (1,10 p)
G) Kémiai termékek tervezését, termelését, felhasználását irányító elvek egységes
alkalmazása, amelyek eredményeként csökken vagy meg is szűnik a környezetre
veszélyes anyagok előállítása és felhasználása. Megj. A cél elérése érdekében a hagyományos
energiaforrások mellett egyre több megújuló energiaforrást kell alkalmazni. (2,5 p)
H) 1.a) Megójuló: olyan közeg, természeti jelenség, amelyekből energia nyerhető naponta többször (tehát ismétlődően rendelkezésre áll) vagy jelentősebb emberi beavatkozás nélkül néhány éven belül újratermelődik. (0,5 p)
b) Nem megújuló: nem termelődnek újra, mert a hasznosításuk során elfogynak, ill. irreverzibilisen átalakulnak. (0,5 p)
2. a) A Nap-, szél-, víz- és geotermikus energia. (0,25 p)
b) A fosszilis tüzelőanyagok (pl. fa, papír, stb.) és atomenergiát biztosító atommaghasadások. (0,25 p)
3. a) A megújuló energiaforrások felhasználása összhangban van a környezetvédelem alapelveivel (nem rombolják a környezetet). (0,5 p)
b) A nem megújuló energiaforrások kitermelésük és felhasználásuk közben szennyezik (szennyezhetik) a környezetet. (0,5 p)
2. a) Növények oxigéntől elzárt bomlásakor keletkező gázelegy, amelynek fő komponense a CH4 és a CO2. Háztartási szerves hulladékokból is keletkezhet hasonló módon. (0,5 p)
b) A tengervízben nagy tömegben élő, majd elhalt parányi élőlények (planktonok) anaerob bomlásából keletkezett gázhalmazállapotú szénhidrogének elegye. Főként telített C1– C4 komponenseket tartalmaznak, legnagyobb arányban a CH4. (0,75 p)
c) Olyan kémiai folyamat, amelynek során megfelelő körülményeken egy adott szerves vegyületmás szerkezetű vegyületté alakul kémiai összetétel változása nélkül (=molekulatömeg változás nélkül). (0,5 p)
d) Ismertebb nevén: geometriai- vagy cisz-transz izoméria, a térizomériának egyik típusa, amely elsősorban az olyan C=C kötést tartalmazó vegyületek jellemzője: a kettős kötésű C-atomokhoz kapcsolódó ligandumok térbeli elrendeződése eltérő. (0,75 p)
e) Egy vegyületnek azok a molekulaszerkezetei, amelyekben ugyanahhoz az atomhoz kapcsolódó ligandumok (atomok / atomcsoportok) egymáshoz viszonyított térbeli elrendeződése eltérő. (0,75 p)
f) Adott szerves vegyületeknek azok az azonos összegképletű molekulái, amelyekben az atomok / atomcsoportok kapcsolódási sorrendje eltérő. (0,5 p)
g) Magas hőmérsékleten nagyobb C-láncú szénhidrogének kisebb C-atomszámú telített és telítetlen szénhidrogénekre (esetleg H2-re is) történő bomlása. (0,75 p)
h) Olyan kémiai reakció, amelynek során egy nagyobb molekulából atomok / atomcsoportok szakadnak le kisebb molekulatömegű két terméket képezve. (0,5 p)
i) Az a kémiai folyamat, amelynek során a szerve molekula egy atomja/ atomcsoportja más atommal / atomcsoporttal cserélődik ki melléktermék kilépése közben. (0,75 p)
j) A nem sík szerkezetű gyűrűs vegyületek gyűrűt alkotó atomjaihoz kapcsolódó ligandumok kötésiránya merőleges a molekula általános síkjára. (0,5 p)
k) A nem sík szerkezetű gyűrűs vegyületek gyűrűt alkotó atomjaihoz kapcsolódó ligandumok kötésiránya a molekula általános síkjában van. (0,5 p)

l) Kizárólag szénhidrogének esetében (vagy szénhidrogén maradékoka) használt ábrázolás, amely a molekula C-vázát tünteti fel H-atomok nélkül. A töréspontokban, valamint a kezdeti és végpontokban C-atomok találhatók, ezek között pedig „ – „, „=” vagy „º” a megfelelő kötéseket jelzi. (0,75 p)
m) Olyan gyűrűs szerves vegyületek, amelyekben a gyűrű felépítésében a C-atomokon kívül más atomok (pl. O, N, S, stb) is előfordul. (0,5 p)
n) Bármely poláris molekula addíciója során a belőle származó anion a C=C szénatompár közül mindig a H-ben szegényebb C-atomhoz kapcsolódik. (0,75 p)
o) Poliolefinek = sok C=C kötést tartalmazó telítetlen szénhidrogének. (0,25 p)
p) Gumi = vulkanizált kaucsuk : a kaucsukot (lásd q-válasz) kénnel és egyéb adalék anyagokkal (korom, színezék, konzerválószerek, stb.) 130 – 140o C-ra melegítik, miközben a kén a C=C kötések egy részére addicionálódik és a polimer láncok között kovalens kötéseket hoz létre. A gumi S-hídakon keresztül összekapcsolt térhálós polimer lesz. A vulkanizálás során a termék hő tűrő képessége megnő és rugalmassága megmarad.(0,75 p)
q) A kaucsuk = izoprén (lásd F.c-válasz) 1,4-polimerizációs cisz szerkezetű természetes polimere. (0,5 p)
3. a) M(CH3Cl) = 50,5 %Cl = 100x35,5/50,5 = 70,29 % Cl (0,5 p)
M(CH2Cl2) = 85 %Cl = 100x2x35,5/85 = 83,52 % Cl (0,5 p)
M(CHCl3) = 119,5 %Cl = 100x3x35,5/119,5 = 84,49 % Cl (0,5 p)
M(CCl4) = 154 %Cl = 100x4x35,5/154 = 92,20 % Cl (0,5 p)
b) PB – gáz = propán és bután elegye
C3H8 + 5O2 ® 3CO2 + 4H2O C4H10 + 6,5O2 ® 4CO2 + 5H2O (1,0 p)
1 mól propán ® 5 mól O2 ® 25 mól levegő és
1 mól bután ® 6,5 mól O2 ® 32,5 mól levegő;
összesen: 57,5 mól levegő / 2 mól PB- gáz vagyis 28,75-ször több levegő! (0,75 p)
c) C8H18 + 12,5O2 ® 8CO2 + 9H2O (g) (0,75 p)
65 mól levegő ® 13 mól O2 + 52 mól N2 (0,75 p)
- keletkezett termékek: 8 mól CO2 + 9 mól H2O(g) = 17 mól gáz
- nem reagált anyagok: 0,5 mól O2 + 52 mól N2 = 52,5 mól gáz (1,0 p)
- végső gázelegy: 69,5 mól ®
11,51 tf.% CO2; 12,94 tf.% H2O(g); 0,719 tf. % O2; 74,82 tf. % N2 (1,0 p)
|
|
I |
H |
|
a) |
-- |
X |
|
b) |
-- |
X |
|
c) |
-- |
X |
4. a) Fekete (vagy szürke) színnel megjelenik az ujjlenyomat. (0,5 p)
b) Az emberi szervezetből állandóan távozik izzadság (ha nem is mindig érezzük), amelynek összetételében főleg víz, kis mennyiségben szerves anyagok valamint a szervezetben jelen lévő NaCl található (és más ásványi anyagok). (0,75 p)
c) A zsír, illetve a smink anyagai tapadnak az ujjhoz nem pedig az izzadságban előforduló vegyületek. Ezért az ujjlenyomat nem mutatható ki. (0,75 p)
d) Az izzadságban található NaCl és az AgNO3 – oldat reakciója során keletkezett AgCl fényérzékeny vegyület = fény hatására elbomlik és fekete (szürke) Ag válik ki, amely leülepszik az ujj bőrének barázdáin és így válik láthatóvá az ujjlenyomat. (1,5 p)
NaCl + AgNO3 ® AgCl + NaNO3 2AgCl + fény ® 2Ag¯ + Cl2 (1,0 p)
5. Sudoku – szélső szorzatokkal
a) (4,0 p)
|
|
|
|
270 |
504 |
|
|
|
252 |
|
|
|
|
8 S· |
1 „VE |
5 EG |
9 SZ |
6 , A |
4 EN |
2 ·S |
7 , G |
3 OD |
|
|
189 |
7 KI |
3 ÜN |
9 DA |
8 SZ |
2 B· |
5 ET |
1 UK |
4 RO |
6 RA |
|
|
48 |
2 GY |
4 K· |
6 Y· |
7 KA |
1 RA |
3 SZ |
8 YÚ |
9 JT |
5 NY |
360 |
|
|
4 G· |
6 Y· |
1 SU |
2 GY |
3 ·C |
9 , S |
7 SZ |
5 RE |
8 ÜK |
280 |
|
126 |
9 É, |
2 K· |
7 KI |
5 LL |
8 ÉK |
1 HO |
3 ÁN |
6 SZ |
4 ·E |
|
|
|
5 EG |
8 SS |
3 ME |
4 SI |
7 LJ |
6 ÁM |
9 ·L |
1 ·A |
2 ZT |
18 |
|
20 |
1 E· |
5 NY |
4 LE |
3 EG |
9 ZO |
8 ·A |
6 VE |
2 AL |
7 SZ |
|
|
|
6 NY |
7 EL |
8 ·T |
1 T· |
4 BE |
2 ÜV |
5 RE |
3 ·É |
9 ÜK, |
135 |
|
|
3 ·É |
9 EL |
2 AZ |
6 KK |
5 . E |
7 OR |
4 SZ |
8 SZ |
1 NN |
32 |
|
|
18 |
315 |
|
|
180 |
112 |
120 |
|
|
|
b) „Vegyünk egy kis darab szenet, akaszszuk sodronyra, gyújtsuk meg egy kissé, hogy csillámljék, s aztán ereszszük le az élenynyel telt üvegbe. Ekkor azonnal észreveszszük,” (0,75 p)
c) Akasszunk kis darab szenet egy drótra, gyújtsuk meg, amíg fényesen ízzani fog (ízzik, de nem ég), ezután eresszük az oxigénnel telt üvegbe. (0,5 p)
d) (1) Amikor az égő szenet kivesszük az oxigént tartalmazó edényből, ennek „fényessége” csökken, mert a levegőben kevesebb az oxigén, mint az edényben. Amikor újra visszatesszük az oxigént tartalmazó edénybe jobban ég, mert itt csak oxigén van, ami az égést táplálja. Itt az égés addig tart, amíg a betett szén elég. (1,0 p)
(2) Nagy mennyiségű szén esetén ennek csak egy része fog elégni, mivel nincs elegendő oxigén az edényben, ezért lesz „vége mindennek”. (0,5 p)
(3) A fentiek alapján a kísérlet csak akkor ismételhető meg, ha az edényt ismét oxigénnel töltjük meg. (0,5 p)
(4) A folyamat során sem az oxigén, sem a szén nem tűnt el, sőt mind a kettő benne van az edényben egy új anyag formájában: ez a gázállapotú CO2 (nem szénsav!) (075 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
6. a) 1 g zsírban vagy olajban levő szabad szerves sav közömbösítéséhez (semlegesítéséhez) szükséges KOH mennyisége mg-ban. (1,0 p)
RCOOH + KOH ® RCOOK + H2O (0,25 p)
b) 1 g zsírban vagy olajban levő szabad és észter alakban kötött savval ekvivalens KOH mennyisége mg-ban. (1,0 p)
RCOOH + KOH ® RCOOK + H2O (0,25 p)
RCOOR’ + KOH ® RCOOK + R’OH (0,5 p)
c) 1 g zsírban vagy olajban levő észterek elszappanosításához (=bázikus hidrolízis) szükséges KOH mennyisége mg-ban. (1,0 p)
RCOOR’ + KOH ® RCOOK + R’OH (0,25 p)
d) 100 g zsír, olaj vagy zsírsav által megkötött (addicionált) jód tömege g-ban. (1,0 p)
A jódszám az adott anyag telítetlenségi mértékét fejezi ki. (0,25 p)
R–CH=CH–COOR’ vagy R–CH=CH–COOH + I2 ® R–CHI–CHI–COOR’ vagy R–CHI–CHI–COOH (0,5 p)
e) 1 g zsírból vagy olajból acetanhidriddel történő acílezés során keletkezett ecetsav semlegesítéséhez szükséges KOH mennyisége mg-ban. (1,0 p)
f) (1) A szappanszám, a b)-válasz alapján, a zsírsav molekulatömegével változik.
200 mg KOH = 3,57 x 10-3 mol KOH
M(zsír/olaj) = 1 g zsír/olaj x 3 mol KOH / 3,57 x 10-3 mol KOH = 840,3 (0,75 p)
190 mg KOH = 3,4 x 10-3 mol KOH
M(zsír/olaj) = 1 g zsír/olaj x 3 mol KOH / 3,4 x 10-3 mol KOH = 882,35 (0,5 p)
Tehát minél nagyobb a szappanszám értéke, annál kisebb molekulatömegű zsírsavak kapcsolódnak a glicerinhez. (0,25 p)
(2) A jódszám, a d)-válasz alapján a zsírsav(ak) telítetlenségét fejezi ki.
70-es jódszám esetén: 0,7 x M(sav) g jód/mól sav (0,75 p)
80-as jódszám esetén: 0,8 x M(sav) g jód/mól sav (0,5 p)
Tehát minél nagyobb a jódszám értéke, annál több a C=C kötések száma (= annál nagyobb a telítetlenség mértéke) a zsírsav molekulában. (0,25 p)