X.-XII. osztály, II. forduló, megoldás
2013 / 2014 –es tanév, XIX. évfolyam
1. a) A „difoszfán” név, mert: H2P – PH2 szerkezetben egyes kötés található úgy, mint az alkánokban. (1,0 p)
b) A „difoszfin” elnevezés nem jogos, mivel az „-in” végződés az alkinek nevében van, ahol hármas kovalens kötés található. (1,0 p)
A P2H4 vegyület a foszfin (PH3) mellett keletkezik; ez utóbbit fémfoszfidok (pl. Ca3P2) vízzel történő reakciójából állítják elő, hasonlóan néhány fémkarbidnak vízzel történő reakciójához, amelyekből C2 – C3 alkinek képződnek. Ezzel magyarázható, hogy a PH3 és a belőle keletkezett P2H4 nevében az „-in” végződés szerepel. (1,25 p)
c) A P-atom 3- és 5-vegyérték állapotban fordul elő és a „foszfor-hidrogén” megnevezés nem utal a vegyületben előforduló P-nak erre a sajátosságára: lehet PH3 vagy PH5. (0,5 p)
d) Primer-foszfin: R – PH2 ; CH3 – PH2 , metilfoszfin.
Szekunder-foszfin: R – PH – R; H3C – PH – CH3 , dimetil-foszfin.
Tercier-foszfin: R3P; (CH3)3P , trimetil-foszfin. (2,25 p)
e) (H3C)(C2H5)(C3H7)P , etil-metil-propil-foszfin (etil-metil-izopropil-foszfin). (0,5 p)
2. a) A: ![]() B:
B: ![]() C:
C: ![]() (0,5
p)
(0,5
p)
b) ![]() - a C-atomok
sp2 hibridállapotban vannak, amelyek síkszerkezetűek,
a vegyértékszög = 120o.
(0,5 p)
- a C-atomok
sp2 hibridállapotban vannak, amelyek síkszerkezetűek,
a vegyértékszög = 120o.
(0,5 p)
c) C-atom rendűsége = adott C-atom hány kötéssel kapcsolódik más C-atomhoz.
F) : minden C-atom C–C kötéssel két másik szénhez; összegképlet: C6H12 . (0,75 p)
d) G): H2C=CH–CH3 , a C=C kapcsolatban sp2 - , míg a C – C kapcsolatban sp3 hibridállapotú C-atom van. (0,5 p)
e) C) –ben, mert 2 db. C=C kötést tartalmaz és E) -ben, HCºCH, amely 1 db. CºC kötést tartalmaz. (0,5 p)
f) A) 13 (0,2p) B) 13 (0,2p) C) 9 (0,25p) D) 4 (0,1p) E) 3 (0,15p) F) 18 (0,3p) G) 8 (0,3p)
g) E) , itt CºC kötés van, amelyben a C-atomok sp-hibridállapotúak és a kötésszög 180o
(0,75 p)
h) C: H2C=CH–CH=CH2 + HCl ® ClH2C–CH=CH – CH3 (0,75 p)
G: H2C=CH–CH3 + HCl ® H3C–CHCl–CH3 (0,75 p)
i) (1) C6H12 + Cl2 ® C6H11Cl + HCl szubsztitúció (0,25 p)
(2) 2CH4 ® C2H2 + 3H2 hőbontás (0,4 p)
(3) C4H6 + 2Br2 ® C4H6Br4 1,2,3,4-tetrabróm-bután; addíció (0,5 p)
(4) C2H2 + HCl ® H2C=CH–Cl addíció (0,35 p)
j) (1) H2C=CH–CH=CH2 + HCl ® ClH2C–CH=CH – CH3 1-klór-2-butén (0,5 p)
(2) H2C=CH–CH=CH2 + HCl ® H3C –CHCl–CH=CH3 2-klór-3-butén (0,5 p)
k) B): C4H10 + 13/2 O2 ® 4CO2 + 5H2O C): C4H6 + 11/2 O2 ® 4CO2 + 3H2O (0,8 p)
F): C6H12 + 9 O2 ® 6CO2 + 6H2O G): C3H6 + 9/2 O2 ® 3CO2 + 3H2O (0,7 p)
3. a) - a gyökök nevei szerinti ábécé sorrendben:
4,6,8,10 – tetraetil – 5,10 – diizobutil – 3,5,8 – triizopropil – 2,3,12 – trimetil – 9 – n-butil – 4,6,7,11 – tetra-n-propil – 9 – szekbutil – 7 tercbutil – trideka – 1,11-dién (4,25 p)
b) C65H128 TE = (65x2+2 – 128)/2 = 2 (1,25 p)
4. a (1) (2) (3)
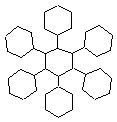
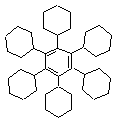
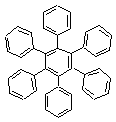 (2,25 p)
(2,25 p)
b) (1) C42H72 és TE = 7; (2) C42H66 és TE = 10; (3) C42H30 és TE = 28; (1,5 p)
c) A ciklohexánnak két térszerkezete ismert: a „szék” és a „kád” forma, amelyek közül a „szék” a stabilabb. Amennyiben az (1) szerkezetben mind a 7 ciklohexán gyűrű a stabilabb szerkezeti formában van jelen, ez a szerkezet „elméletileg” létezhet, mivel az „oldalláncok” térben kevésbé gátoltak. Ezzel szemben a (3)-as szerkezet minden gyűrűs komponense síkszerkezetű (7 benzol gyűrű) és így a molekula is síkszerkezetű. Ez viszont térben gátolt, mivel az oldallánc benzol gyűrűinek H-atomjai a síkban nem „férnek” el. (Próbáld ki modellekkel elkészíteni a molekulákat vagy mértanilag felrajzolni a megfelelő kötéstávolságokkal!). Tehát a (3)-as szerkezet a leginstabilabb. (4,25 p)
5. a) X cm3 CnH2n+2 és (10 – X) cm3 CnH2n-2
(10 – X) cm3 CnH2n-2 + 2 (10 – X) cm3 H2 ® (10 – X) cm3 CnH2n+2
- dién térfogata = 2,5 cm3 Þ elegy összetétele: 75 % alkán + 25 % dién (2,0 p)
b) M(CnH2n+2) = 14n + 2 és M(CnH2n-2) = 14n – 2
M (elegy) = [75(14n+2) + 25(14n-2)]/100 = 14n + 1
1,78 = (14n+1)/32 Þ n = 4 alkán: C4H10 és dién: C4H6 (2,5 p)
6. a) CaC2 + 2H2O ® Ca(OH)2 + C2H2 (0,5 p)
b) M(C2H2) = 26, amely kisebb, mint M(lev) = 28,9, ezért nyílt rendszerben távozik a reakció során, így nem lehetne a kísérletet elvégezni. (1,0 p)
Az C2H2 vízben kismértékben oldódik, így az ezzel végrehajtott reakció hatásfoka csökken. (0,5 p)
c) Vakító, kormozó lánggal ég. Kormozó, mert a C/H arány nagy viszonyítva pl. az alkánokhoz, ezért a C egy része nem tud elégni és bomlás során kiválik. (Csak a hegesztésnél használt égési folyamatban nincs kormozó láng, mert ott csak tiszta oxigént használnak.) (1,25 p)
d) HCºCH + 2Br2 ® Br2HC–CHBr2 1,1,2,2-tetrabróm-etán (0,75 p)
A folyamat során látható változás: a brómos víz kezdeti vörös-barna színe a bevezetett gáz hatására fokozatosan elszíntelenedik, mert az acetilén megköti (addicionálja) a barna színű brómot, a keletkezett termék pedig színtelen. (1,0 p)
7. b) (1) allén; H2C=C=CH2 ; propadién (2) cetán; n-C16H34 ; n-hexadekán
(3) diacetilén, HCºC – CºCH ; 1.3-butadiin (4) divinil: H2C=CH–CH=CH2 ; 1,3-butadién
(5) heptanaftén; ciklo-C7H14 ; cikloheptán (6) hexahidrobenzol; ciklo-C6H12 ; ciklohexán
(7) izooktán; (CH3)3C–CH2(CH3)2 ; 2,2,4-trimetil-pentán
(8) izoprén; H2C=C(CH3)–CH=CH2 ; 2-metil-1,3-butadién (9) mocsárgáz; CH4 ; metán
(10) neohexán; (CH3)3C–CH2–CH3 ; 2,2-dimetil-bután 10x(0,1+0,25+0,15)= 5,0 p
a)
|
Q |
V |
R |
T |
S |
E 29 |
N |
K |
G |
B |
P |
L |
Z |
A
|
H |
F
|
O |
D |
Y |
I |
U |
J |
X |
C |
M |
|
X |
J |
P |
C |
H |
O |
I |
Y |
U |
L |
D |
N |
T |
E 7 |
V |
B |
S |
Q |
M |
R |
G |
F |
Z |
K |
A 32 |
|
A 1 |
G |
O 56 |
N |
Z 51 |
H |
V |
D 11 |
P |
C |
Y |
M |
Q |
B |
F |
K |
U |
T |
J |
X |
E |
L 2 |
I |
S |
R |
|
L |
I 44 |
Y |
K |
M |
T |
Q |
F |
J |
Z |
S |
X 41 |
O 52 |
U |
R |
C |
N |
A 9 |
G |
E 67 |
D |
H 43 |
V |
P |
B |
|
E |
B |
D |
F |
U |
R |
M |
X |
A |
S |
J |
I |
G |
C |
K |
Z |
H |
P |
L |
V |
O |
Q |
T |
N 68 |
Y |
|
G |
X |
L 3 |
M |
Q |
N 50 |
A |
S |
Z |
U |
B |
Y |
K |
J |
P |
O 80 |
C |
E 19 |
D |
H |
T |
I |
R |
F |
V |
|
I 54 |
K |
E |
B |
A |
L |
F |
P |
M |
J |
R |
C 71 |
D |
Z |
U |
Y |
V |
X |
Q |
T |
N 10 |
S |
H |
O |
G |
|
U |
Z |
J |
R |
P |
G 75 |
O |
V |
K |
T |
H |
E |
I |
Q |
M |
A |
L |
N 61 |
S |
F |
X |
C |
B |
Y |
D |
|
O |
H |
N 25 |
Y |
C |
D |
R |
B |
E |
Q |
X |
S |
V |
F |
T |
G |
I |
M |
Z |
U |
L |
K |
J |
A 34 |
P |
|
T |
D |
F |
S |
V |
I 12 |
X |
C |
Y |
H |
G |
A |
L 18 |
O 47 |
N |
R |
B |
K |
P |
J |
Z |
M |
E 79 |
U |
Q |
|
M |
Q |
A |
I 17 |
Y |
K 58 |
S |
G |
C |
O |
E 37 |
B |
R |
P |
Z 77 |
U |
X |
J |
H |
D 21 |
V |
T |
F |
L |
N |
|
F |
P 30 |
V |
Z |
X |
M |
J |
E |
T 8 |
N |
U |
O |
C |
Y |
I |
Q |
G |
B |
R |
L |
S |
D 45 |
A |
H 39 |
K |
|
D |
O 64 |
U |
H |
L |
P |
B |
Q |
X |
I 24 |
K |
T |
A |
G |
S 72 |
V |
Y |
C |
F 35 |
N |
R 66 |
E |
M |
J |
Z |
|
J |
S |
K |
E 40 |
N |
Y |
U |
Z 63 |
D |
R |
F |
V |
M |
H |
L 53 |
P |
T |
O |
I |
A |
Q |
X |
G |
B |
C |
|
R |
C |
B |
G |
T |
V |
L |
H |
F |
A 76 |
N 20 |
Q |
J |
D |
X 83 |
E |
M |
S |
K |
Z |
Y |
P |
U |
I |
O |
|
B |
N 85 |
G |
V 23 |
D |
A 42 |
Y |
T |
S |
F |
Q |
P |
H 81 |
M |
C |
X |
R |
Z 55 |
U |
K |
J |
O 70 |
L |
E |
I |
|
C |
M 69 |
T |
U |
E |
Q |
K |
O |
H |
X |
L |
G |
F |
R |
Y |
I |
J |
V |
N |
B |
A 13 |
Z |
P 65 |
D |
S |
|
H |
F |
S |
L |
O |
J |
C 6 |
I 62 |
V |
P |
Z |
K |
X |
N |
A 84 |
D |
E 82 |
G |
T |
Q |
B |
R |
Y |
M |
U |
|
K |
A |
X |
J |
R |
Z |
E |
L |
N |
M |
I |
D |
U |
T 31 |
B |
S |
F |
Y |
O |
P |
C |
G |
Q |
V |
H 28 |
|
Z |
Y |
Q |
P |
I |
U |
D |
R |
B |
G |
O |
J |
S |
V |
E 4 |
H |
A |
L |
C |
M |
F |
N 38 |
K |
X |
T |
|
N |
U |
M |
D |
J |
S |
G |
A |
R |
Y |
T |
H |
E |
K |
Q |
L 27 |
P |
F |
B |
O |
I |
V |
C |
Z |
X |
|
V |
L |
I 22 |
Q |
F |
B |
H |
N 33 |
O |
E |
A |
Z |
P |
S |
G |
T 59 |
K |
U |
X |
C |
M |
Y |
D |
R 46 |
J |
|
Y |
R 74 |
C |
A 73 |
G |
X |
P |
J |
Q |
D |
V |
F |
B 48 |
I 26 |
O 57 |
M |
Z |
H |
E 15 |
S |
K |
U |
N 78 |
T 16 |
L |
|
S |
T 36 |
H |
X |
B |
F |
Z |
M |
I |
K |
C |
U |
Y |
L |
J |
N |
D |
R |
V |
G |
P |
A |
O |
Q |
E |
|
P
|
E 49 |
Z |
O |
K |
C 14 |
T |
U |
L |
V |
M |
R |
N 5 |
X |
D |
J |
Q |
I |
A 60 |
Y |
H |
B |
S |
G |
F |
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
8. a) (1) Egy mól elektron töltésének abszolút értéke. (0,5 p)
(2) F = 96485,3399 C/mol » 96500 C/mol (0,4 p)
(3) Az Avogadro-szám és az elektron elemi töltésének szorzatából kapott érték:
6,023x1023x1,602x10-19 = 96488 (1,0 p)
b) (1) Az atomok elektronjainak energiáját jellemző szám(ok). (0,5 p)
(2) Főkvantumszám = elektronhéjak száma; jele: n; értékei: n = 1, 2, 3, …. (0,4 p)
Mellékkvantumszám = alhéjak száma; jele: l; értékei: l = n – 1 (0, 1, 2, ….) (0,5 p)
Mágneses kvantumszám = orbitálok száma; jele: m; értékei: –l ….. 0 ….. +l (0,55 p)
Spinkvantumszám = az elektronok lehetséges száma egy orbitálon;
jele ms; értékei: +1/2 és –1/2 (0,4 p)
(Megj. a Pauli féle kizárási törvény szerint nincs két elektron egy atomban, amelynek mind a négy kvantumszáma megegyezik.)
c) (1) A motorbenzin kompresszió tűrését (kopogásállóságát) jellemző érték. (0,5 p)
(2) Az izooktán (2,2,4-trimetil-pentán) o.sz. = 100, a n-heptán o.sz. = 0 (megállapodás értelmében. (0,5 p)
(Az o.sz. a fenti két anyag keverékével azonos hatásfokú benzin kompresszió tűrésű elegyét jelöli. Pb-tetraetil adalékanyagot alkalmaztak az o.sz. növelésére, de környezetvédelmi okok miatt ezt betiltották.)
d) (1) A cetánszám a dízelolajok öngyulladási jellemzésére szolgáló szám. (0,25 p)
(2) Felső határ (cetánszám = 100) a n-cetán; alsó határ (cetánszám = 0) az alfa-metil-naftalin. (0,5 p)
(3) n-cetán – lásd rejtvény (2) válasz;
alfa-metil-naftalin: ![]() (0,25 p)
(0,25 p)
e) Az oxidációs szám valamely atom névleges vagy valódi töltésének előjeles egész számértékével azonos érték. (0,75 p)
f) (1) A komplex vegyületek központi atomjához/ ionjához kapcsolódó ligandumok (ionok vagy molekulák) száma. (0,75 p)
(2) A maximális koordinációs szám = 12. (0,25 p)
(3) A leggyakrabban 4 és 6 értékek fordulnak elő. (0,25 p)
9. Szervetlen szulfidok: a kénnek egy elektropozitívabb elemmel alkotott vegyületei.
Pl. H2S, Na2S, MgS, stb. (0,75 p)
Szerves szulfidok általános képlete: R – S – R’, ahol R, R’ – szénhidrogén csoportokat jelöl.
Tioétereknek is nevezik, mivel az éterek O-atomját itt S-atom helyettesíti. (1,0 p)