X.-XII. osztály, IV. forduló, megoldás
2013 / 2014 –es tanév, XIX. évfolyam
1. a) SiH4, színtelen, gáz. A vegyület molekulájában az atomarány megfelel a metánnak
(általánosan: alkánnak), mert a Si-atom a C-atomhoz hasonlóan 4 vegyértékű. Ezért van jelen a névben az „-án” végződés. (1,5 p)
b1) SinH2n+2 (0,5 p)
b2) SiH4 – monoszilán; Si2H6 – diszilán; Si3H8 – triszilán; Si4H10 – tetraszilán; Si5H12 – pentaszilán; Si6H14 – hexaszilán. (3,0 p)
b3) Alkén, alkin, arén típusú Si- és H-tartalmú vegyületek nem léteznek. (0,75 p)
b4) A SiH4 (monoszilán) kivételével levegővel érintkezve meggyulladnak SiO2 és víz keletkezése közben: SinH2n+2 +(3n+1)/2O2 ® nSiO2 + (n+1)H2O (1,25 p)
b5) A SiH4 csak melegítve reagál az oxigénnel: SiH4 + 2O2 ® SiO2 + 2H2O (0,75 p)
b6) SinH2n+2 + 2nH2O ®nSiO2 + (3n+1)H2 (1,5 p)
2. a) (1) CnH2n+2O; CH3OH; metanol; metil-alkohol; faszesz. (0,65 p)
(2) CnH2nO; H2C=CH–CH2–OH ; 2-propén-1-ol; allil-alkohol. (0,7 p)
(3) CnH2n-2O; HCºC–CH2–OH ; 2-propin-1-ol. (0,7 p)
(4) CnH2n+2O2; HO–CH2–CH2–OH ; etándiol; glikol. (0,7 p)
(5) CnH2nO2; H2C=CH–CH(OH)–CH2OH vagy HOCH2–CH=CH–CH2OH
3-butén-1,2-diol vagy 2-butén-1,4-diol (0,8 p)
(6) CnH2n-2O2; HCºCH–CH(OH)–CH2OH vagy HOCH2–CºC–CH2OH
3-butin-1,2-diol vagy 2-butin-1,4-diol (0,8 p)
(7) CnH2n+2O3; HOCH2–CH(OH)–CH2OH ; 1,2,3-propántriol; glicerin. (0,8 p)
(8) CnH2nO3; H2C=CH–CH(OH)–CH(OH)–CH2OH; 4-pentén-1,2,3-triol. (0,8 p)
(9) CnH2n-2O3; HCºCH–CH(OH)–CH(OH)–CH2OH; 4-pentin-1,2,3-triol. (0,8 p)
b) (1) CnH2n-7O(CaH2a+1) ; a = min. 1: C6H5O(CH3), ill. HO–C6H4–CH3
2-metil-fenol; orto-krezol (vagy meta-, para-izomerek) (0,7 p)
(2) CnH2n-7O(CaH2a-1) ; a = min. 2 : C6H5O(C2H3), ill. HO–C6H4–CH=CH2
2-vinil-fenol = orto-vinil-fenol vagy 2-hidroxi-vinil-benzol = orto-hidroxi-vinil-benzol, vagy a meta-, para-izomerek (0,8 p)
(3) CnH2n-7O(CaH2a-3) ; a = min. 2 : C6H5O(C2H), ill. HO–C6H4–CHºCH
(2-hidroxi-fenilén)-acetilén = (orto-hidroxi-fenilén)-acetilén, vagy meta-, para-izomerek (0,8 p)
(4) CnH2n-7O2(CaH2a+1) ; a = min. 1: C6H5O2(CH3), ill. (HO)2C6H3–CH3
dihidroxi-metil-benzol; dihidroxi-toluol; hidroxi-metil-fenol; hidroxi-krezol.(0,8 p)
(5) CnH2n-7O2(CaH2a-1) ; a = min. 2 : C6H5O2(C2H3), ill. (HO)2C6H3–CH=CH2
dihidroxi-vinil-benzol (0,8 p)
(6) CnH2n-7O2(CaH2a-3) ; a = min. 2 : C6H5O2(C2H), ill. (HO)2C6H3–CHºCH
(dihidroxi-fenilidén)-acetilén (0,8 p)
(7) CnH2n-12(CaH2a+1)6 ; a = min. 1: C6(CH3)6 ; hexametil-benzol (0,8 p)
3. a) Az alkohol (R–OH) molekulák között kialakul a H-híd kötés az -OH csoportok jelenléte
miatt. Ez a legerősebb intermolekuláris kapcsolat, ezért az alkoholoknak magas a f.p. értéke. Az étermolekulák (R–O–R’) nem tudnak H-híd kötéseket létesíteni egymással, mert szerkezetükben nincs –OH csoport, csak oxigénhez kapcsolt apoláris szénhidrogén maradékok. (1,5 p)
A C-atomok számának növekedésével a f.p. értékek közötti különbség azért csökken, mert a nagy C-atomszámú alkoholokban az apoláris szénhidrogén részek hatása érvényesül és ezért a molekulák közötti kölcsönhatások erőssége csökken. (1,0 p)
Pl. C2H6O: H3C–O–CH3 , f.p. = -24oC és C2H5OH , f.p. = +78o C;
- a f.p. különbség = +78–(–24) = 102o C
C4H10O: H5C2–O–C2H5 , f.p. = +35o C és CH3(CH2)3OH , f.p. = +118o C;
- a f.p. különbség = +118–(+35) = 83o C (1,0 p)
b) Étermolekulák szerkezete – lásd a)-választ. Az alkán molekulák – összetételükből és szerkezetükből adódóan – apolárisak. Ezért a közelálló molekulatömegű komponensek forráspontjai is közeli értéket mutatnak. A kis C-atomszámú éterek esetében nagyon enyhe poláris jelleg alakul ki az O-atom jelenléte miatt. Ez teljesen megszűnik a több C-atomos komponensek esetében, ahol az apoláris szénhidrogén csoport hatása érvényesül. (1,25 p)
Pl. H3C–O–CH3 , M = 46, f.p. = -24oC és C3H8 , M = 44, f.p. = -42oC
H5C2–O–C2H5 , M = 74, f.p. = +35o C és C5H12 , M = 72, f.p. = +36o C (0,5 p)
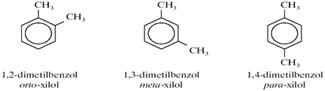
c) Az orto-izomer a „legpolárisabb”
az oldalláncok egymásjoz viszonyított helyzete miatt. Ez a polarítás teljesem megszűnik a para-izpomerben, amely szimmetrikus térszerkezetű.
A poáris vagy enyhén poláris molekulák közötti vonzóerő nagyobb, mint az apoláris molekulák között. A növekvő f.p. értékek sorrendje: p-xilol < m-xilol < orto-xilo.
(1,25 p)
4. A) – legyen X% etanol = anyagmennyiség (mól szám) koncentráció
M(C2H5OH) = 46 és M(H2O) = 18 (0,25 p)
100 mol oldatban van: X mol C2H5OH + (100-X) mol H2O
100 mol oldat tömege: m(oldat) = 46X+(100-X)18 = (1800+28X) g
(1800+28X) g oldat …………………..46X g etanol
100 g oldat …………………….2X g etanol X = 17,85 % etanol/100 mol oldat
- az oldat tömegszázalékos koncentrációja: 2X = 35,7 m/m% (3,0 p)
- a fenti tömegszázalékos koncentrációjú oldat létezhet, mert az oldott anyag koncentrációja reális értéket jelent (< 100%) (0,25 p)
B) 100 mol oldatban van: X mol C2H5OH + (100-X) mol H2O
100 mol oldat tömege: m(oldat) = 46X+(100-X)18 = (1800+28X) g
- az oldat tömegszázalékos összetétele:
(1800+28X) g oldat …………………..46X g etanol
100 g oldat …………………….0,5X g etanol
X = 264,28 % anyamennyiség(mol) etanol/100 mol oldat – ez irreális érték , mert a koncentráció > 100 %, a feloldott anyagmennyiség több, mint az oldat anyagmennyisége – ezért lehetetlen; (az oldat tömegszázalékos konc.= 132,14 m/m%!) (2,5 p)
5. a) Mindhárom kémcsőben a komponensek elegyedése (oldódása) figyelhető meg. Az etanol:
CH3CH2OH szerkezetében található -OH csoport poláris jellegű, míg a szénhidrogén rész apoláris tulajdonságú. Az oldószer vagy a feloldandó anyag molekuláinak polaritásától függetlenül az etanol minden esetben elegyedik, mivel a két különböző sajátságú része kb. azonos hatású (a molekula mérete miatt). (2,75 p)
b) Kékes lánggal ég: C2H5OH + 3O2 ® 2CO2 + 3H2O (0,75 p)
c) Az oldat semleges kémhatást mutat. A H2O és C2H5OH molekulák között H-híd kötések alakulnak ki (ezért oldódik az etanol vízben), de nem történik H+-átvitel, ezért az elegy kémhatása sem savas (H+-leadás) sem bázikus (H+-felvétel) nem lehet, csak semleges.(1,0 p)
6. a) (4,5 p)
|
|
3 |
6 |
9 |
4 |
1 |
5 |
7 |
8 |
|
CI |
NV |
TI |
SN |
TI |
LD |
IN |
BL |
OÉ |
|
1 |
4 |
5 |
3 |
8 |
7 |
2 |
6 |
9 |
|
AO |
AD |
EF |
NI |
NO |
IU |
LX |
RL |
LR |
|
7 |
8 |
9 |
5 |
6 |
2 |
3 |
1 |
4 |
|
AM |
OE |
AL |
SM |
LI |
IN |
OH |
TÉ |
RE |
|
4 |
9 |
8 |
6 |
2 |
5 |
1 |
3 |
7 |
|
TS |
NR |
NA |
SV |
BI |
LA |
KL |
LT |
RK |
|
3 |
6 |
2 |
1 |
7 |
8 |
4 |
9 |
5 |
|
EN |
EK |
LI |
GB |
ÉO |
NV |
RO |
NA |
IL |
|
5 |
1 |
7 |
4 |
9 |
3 |
6 |
8 |
2 |
|
IN |
TS |
OI |
CA |
GR |
KV |
DH |
ID |
LA |
|
6 |
7 |
1 |
2 |
5 |
9 |
8 |
4 |
3 |
|
LR |
TA |
II |
AD |
IT |
NT |
IE |
KE |
ET |
|
8 |
2 |
3 |
7 |
1 |
4 |
9 |
5 |
6 |
|
CV |
OL |
AM |
ZN |
ZI |
OE |
EI |
AT |
TÁ |
|
9 |
5 |
4 |
8 |
3 |
6 |
7 |
2 |
1 |
|
EJ |
CL |
CO |
EA |
UI |
CO |
DL |
IR |
OT |
b) (1) acetilaceton: CH3COCH2COCH3; 2,4-pentándion; pentán-2,4-dion (0,5 p)
(2) acetonilaceton: CH3COCH2CH2COCH3; n-hexán-2,5-dion (0,5 p)
(3) agancsszesz: NH4OH , ammónium-hidroxid (0,5 p)
(4) butilénglikol: CH3CH(OH)CH(OH)CH3 ; 2,3-butándiol; bután-2,3-diol (0,5 p)
(5) cinnklorid: SnCl4; ón-tetraklorid; ón(IV)-klorid (0,5 p)
(6) dietilkarbinol: C2H5CH(OH)C2H5 ; pentán-3-ol; izoamil-alkohol (0,5 p)
(7) eritrol: HOCH2CH(OH)CH(OH)CH2OH ; butántetrol; bután-1,2,3,4-tetrol (0,5 p)
 (8) divinilénoxid: furán
(furfurán) (0,5 p)
(8) divinilénoxid: furán
(furfurán) (0,5 p)
![]() (9) fluorén o-difenilén-metán
(0,5 p)
(9) fluorén o-difenilén-metán
(0,5 p)
(10) hemimellitsav: 1,2,3-(HOOC)3C6H3 ; 1,2,3-benzol-trikarbonsav (0,5 p)
(11) karbinol: CH3OH; metil-alkohol; metanol (0,5 p)
(12) kovasavanhidrid: SiO2; szilíciumdioxid (0,5 p)
(13) tetraetilmetán: C(C2H5)4 ; 3,3-dietil-pentán (0,5 p)
(14) vitriololaj: H2SO4 ; kénsav (0,5 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
7. a) (1) az aldehidek 2 alkohol molekulával alkotott vegyületei: RCH(OR)2 (0,5 p)
(2) az ecetsav sói, illetve észterei: CH3COOMe és CH3COOR (0,5 p)
b) (1) alifás (alkán, alkén, alkin) szénhidrogén maradékot tartalmazó aldehidek (0,25 p)
(2) alifás (alkán, alkén, alkin) szénhidrogén maradékot tartalmazó alkoholok (0,25 p)
c) (1) lehet: a C6H5CH2– szénhidrogénmaradék
vagy : C6H5–CO–CO–C6H5 1,2-difeniletán-1,2-dion (0,5 p)
(2) 1,2-didehidrobenzol (vagy: 1,2-dodehidrobenzol), C6H4 – a legegyszerűbb arin (0,5 p)
d) (1) két –CH=O (aldehid) csoportot tartalmazó vegyületek; HOC–COH; etándial; glioxal(0,5p)
(2) két – OH csoportot (telített C-atomon) tartalmazó vegyületek; HOCH2CH2OH; etándiol; glikol (0,5 p)
(3) két –CO– (keton) csoportot tartalmazó vegyületek; H3C–CO–COCH3; butándion (0,5 p)
e) (1) két vegyértékű szénhidrogén maradék; :CH2 ; metilén (0,5 p)
(2) három vegyértékű szénhidrogén maradék; CH ; metilidin (0,5 p)
f) (1 =(2)=karbokation, szerves ion, amelynek pozitív töltése van a C-atomon (0,75 p)
g) (1) az etánsav = ecetsav sója vagy észtere (0,25 p)
(2) a metánsav = hangyasav sója vagy észtere (0,25 p)
h) (1) egy O-atomot és két C=C kötést tartalmazó hattagú heterociklusos vegyület, molekulaképlete: C5H6O (0,75 p)
(2) egy O-atomot és két C=C kötést tartalmazó hattagú heterociklusos ketonszármazék , molekulaképlete: C5H4O2 (0,75 p)
(Megj. egyik sem aromás jellegű. Mert a 6 tagú gyűrűben nem alakul ki delokalizált elektron rendszer.)
i) (1) = (2) = a propénsav = akrilsav, H2C=CH–COOH, sója vagy észtere (0,75 p)
j) (1) H2C=CH–COH, propionaldehid, akrolein (0,5 p)
(2) H2C=CH–CH2OH, allil-alkohol (0,5 p)
(3) CH3CH2CH2OH, n-propanol, propán-1-ol; CH3CH(OH)CH3, izopropanol, proán-2-ol (0,5 p)