X.-XII. osztály, II. forduló, megoldás
2014 / 2015 –ös tanév, XX. évfolyam
1. a) Diének = két C=C kötést tartalmazó nyílt C-láncú szénhidrogének. Szimmetrikus
szerkezetű második tag: H2C=CH–CH=CH2 ; 1,3 –butadién ; CnH2n+2 (1,0 p)
Diinek = két CºC kötést tartalmazó nyílt C-láncú szénhidrogének. Szimmetrikus
szerkezetű második tag: HCºCH–CH2–CºCH ; 1,4 –pentadiin ; CnH2n–6 (1,0 p)
b) Acetilén: C2H2 (HCºCH) (0,25 p)
Acetilének = alkinek: nyílt C-láncú, egy CºC kötést tartalmazó szénhidrogének (0,75 p)
- általános képlet: CnH2n–2 n = min. 2, 10. tag: C11H20 , undekin (0,5 p)
Acetilidek: a C2H2 olyan származékai, amelyekben ennek egy vagy mindkét H-atomját fém helyettesíti. (0,5 p)
![]() c) Arin = egy arénből
(aromás szénhidrogén) két szomszédos H-atom elvonásával, vagyis egy C=C
kötésnek CºC kötéssé
alakításával keletkezett vegyületek.
c) Arin = egy arénből
(aromás szénhidrogén) két szomszédos H-atom elvonásával, vagyis egy C=C
kötésnek CºC kötéssé
alakításával keletkezett vegyületek.
Legegyszerűbb: benzin (1,0 p)
Arzin = AsH3, színtelen, mérgező gáz. (0,25 p)
2. a) (1) 2db. –C3H5 + 2db. –C2H5 + 1db. –C3H7 + 4db. –CH3 +2db. –C2H3 + 10 C-atom a
főláncban = 31 C-atom (0,75 p)
(2) 2db. –C2H3 + 1db. –C2H5 + 1db. –C3H7 + 1db. –C5H11 + 1db. –C3H7 + 5 C-atom a főláncban = 22 C-atom (0,75 p)
(3) 8db. –C2H3 + 1db. –C2H5 + 1db. –C2H + 3db. –CH3 + 1db. –C3H7 + 13 C-atom a főláncban = 27 C-atom (0,75 p)
(4) 1db. –C4H9 + 2db. –CH3 + 1db. –C3H3 + 1db. –C3H3 + 1db. –C4H9 + 1db. –C4H9 + 9 C-atom a főláncban = 29 C-atom (0,75 p)
b) Triviális szénhidrogén csoportok neve és a megfelelő szisztematikus név: allil = 2-propenil
és vinil = etenil; az (1)-es elnevezés helyesen: 3,7-dietenil-4,8-dietil-4-izopropenil-5,5-
di(2-propenil)-2,6,6,9-tetrametil-deka-2,7-dién. (1,0 p)
c) 1 db. pi-kötés vagy egy gyűrű = 1 TE
(1) 2 db. allil: TE = 2x1; 2 db. etil: TE = 0; 1 db. izopropenil: TE = 1; 4 db. metil: TE = 0;
2 db. vinil: TE = 2x1; dekadién: TE = 2; összesen: TE = 7 (1,0 p)
(2) 2 db. eteil: TE = 2x1; 1 db. etil: TE = 0; 1 db. izopropil: TE = 0; 1 db. neopentil: TE =0;
1 db. normálpropil: TE = 0; ciklopentadién: TE = 1+2; összesen: TE = 5 (1,0 p)
(3) 2 db. etenil: TE = 2x1; 1 db. etil: TE = 0; 1 db. etinil: TE = 2; 3 db. metil: TE = 0;
1 db. normálpropil: TE = 0; tridekatetrain: TE = 4x2; összesen: TE = 12 (1,0 p)
(4) 1 db. izobutil: TE = 0, 2 db. metil: TE = 0; 2 db. propinil: TE = 2x2; 1 db. szekbutil: TE = 0; 1 db. tercbutil: TE = 0; nona-diin-én: TE = 2x2+1; összesen: TE = 9 (1,0 p)
d) (1) CnH2n+n-2x7 képletnek felel meg, mert TE = 7; 31 C-atom: C31H50 (0,25 p)
(2) CnH2n+n-2x5 képletnek felel meg, mert TE = 5; 22 C-atom: C22H36 (0,25 p)
(3) CnH2n+n-2x12 képletnek felel meg, mert TE = 12; 27 C-atom: C27H32 (0,25 p)
(4) CnH2n+n-2x9 képletnek felel meg, mert TE = 9; 29 C-atom: C29H42 (0,25 p)
3. a) (4) H2C=CH–CH=CH2 (5) H3C–CH=CH–CH3 (11) H2C=C=CH2
(14) H2C=C(CH3)–CH=CH2 (15) H2C=CCl–CH=CH2 (16) H2C=CH–CºCH
(17)
![]() (7x0,15=1,05
p)
(7x0,15=1,05
p)
b)
|
Kijelentés |
Sorszámok |
Kijelentés |
Sorszámok |
|
Van geometriai izomerje |
5 (0,2) |
Izomerek |
2 és 3 6, 9 és 10(0,35) |
|
Azonos molekulatömegűek, de nem izomerek |
2 és 13 3 és 13 6 és 12 9 és 12 10 és 12 (0,75) |
Telített vegyületek |
2, 3, 12, 13 (0,4) |
|
Egyszeresen telítetlen vegyületek (TE=1) |
5, 6, 7, 8, 9, 10 (0,6) |
Kétszeresen telítetlen vegyületek (TE=2) |
1, 4, 11, 14, 15, 17 (0,6) |
|
Homológ sorának általános képlete: CnH2n-2 |
1, 4, 11, 14 (0,4) |
Homológ sorának első, stabil tagja |
1, 3, 6, 7, 10, 11, 13, 16 (0,8) |
|
Homológ sorának második stabil tagja |
2, 4, 8, 15, 17 (0,5) |
sp-hibridállapotú C-atomo(ka)t is tartalmaz |
1, 11, 16 (0,3) |
|
Két féle hibridállapotú C-atomot tartalmaz |
5, 6, 8, 9,10, 11, 14,16,17(0,8) |
Csak azonos hibridállapotú C-atomokat tartalmaz |
1, 2, 3, 4, 7,12, 13, 15 (0,8 p) |
c)
|
S.sz |
M |
S.sz |
M |
S.sz |
M |
S.sz |
M |
S.sz |
M |
S.sz |
M |
|
(1) |
26 (0,05) |
(2) |
46 (0,05) |
(3) |
46 (0,05) |
(4) |
54 (0,1) |
(5) |
56 (0,1) |
(6) |
58 (0,05) |
|
(7) |
28 (0,05) |
(8) |
42 (0,05) |
(9) |
58 (0,05) |
(10) |
58 (0,05) |
(11) |
40 (0,1) |
(12) |
58 (0,05) |
|
(13) |
46 (0,05) |
(14) |
68 (0,1) |
(15) |
88,5 (0,1) |
(16) |
52 (0,1) |
(17) |
82 (0,1) |
--- |
--- |
d) Az izoprén (14), amelynek polimerje lehet cisz-szerkezetű: ez a természetes kaucsuk,
és transz-szerkezetű, amely a guttapercha néven ismert természetes polimer. (1,25 p)
4. a) –CH3 csoportok száma / „óriás” molekula = 64 db;
–CH2– csoportok száma / „óriás” molekula = 32 db. (1,0 p)
(Megj. 1/8 molekulában: 4 db. –CH2– és 8 db. –CH3)
b) H-nélküli C-atom: 1/8 molekulában = 320 db. és:
- amennyiben 8 részre osztottad a molekulát: 4 felező vonal mentén 8-8 közös H nélküli C-atom, míg a másik 4 felező vonal mentén 4-4 H nélküli C-atom található = 4x8 + 4x4 = 48 C-atom;
- a –CH3, –CH2– csoportok C-atomjai valamint a fentiek összesen: 32+64+320+48 = 464 C
- a –CH3 és –CH2– csoportokban a H-atomok száma: 3x64 + 2x32 = 256 H
- molekulaképlet: C464H256 (2,0 p)
c) TE = (2x464+2–256)/2 = 337 (0,5 p)
d) 3, 4, 6 és 8-C-atomos gyűrűkből adódik, amelyeknek száma összesen 337. (1,0 p)
e) 3 C-atomos gyűrű= 224 db.; 4 C-atomos gyűrű = 9 db.; 6 C-atomos gyűrű = 88 db. ;
8 C-atomos gyűrű = 16 db. (224+9+88+16=337) (2,0 p)
f) Összesen 464 db. C / molekula; ebből 64 C-atom –CH3 csoportban, és 32 C-atom –CH2– csoportban található, a többinek nincs H-je: 368 db. negyedrendű C-atom. (1,5 p)
5. a) Az aceton (CH3COCH3) (0,25 p)
b) M(C2H2) = 26 (1) m(oldat) = 1000 g aceton + 26 g C2H2 = 1026 g oldat
m/m% = 100x26/1026 = 2,53 %-os acetonos C2H2 oldat (0,75 p)
(2) r = m/V m(oldat) = 0,8x1000 = 800 g oldat
m/m% = 100x26/800 = 3,25 %-os acetonos C2H2 oldat (0,75 p)
c) (1) molalitás = az oldott anyag anyagmennyisége (mólok száma) 1000 g oldatban (0,5p)
(2) molaritás = oldott anyag anyagmennyisége (mólok száma) 1 dm3 oldatban (0,5 p)
d) M(aceton, CH3COCH3) = 58 (0,25 p)
(1)-es oldat anyagmennyiség összetétele: 1 mol C2H2 és 1000/58 = 17,24 mol oldószer
- összesen: 18,24 mól anyag / 100 mól oldat Þ 5,48 % C2H2 és 94,52 % oldószer (1,0 p)
(2)-es oldat anyagmennyiség összetétele:
1 mol C2H2 és 800 – 26 = 774 g oldószer = 13,34 mol oldószer
- összesen: 14,34 mól anyag / 100 mól oldat Þ 6,97 % C2H2 és 93,03 % oldószer (1,0 p)
6. a) Tágabb értelemben = alkánok; szűkebb értelemben = > C12 alkánok, amelyek szobahőmérsékleten szilárd állapotúak. (0,5 p)
b) A „paraffingyertyák” fő kémiai komponensei a paraffinok (>C15 alkánok). (0,25 p)
c) (1) Hőbontás = krakkolás; az alkánok (paraffinok) egyik jellemző tulajdonsága, hogy hő hatására kisebb C-atomszámú alkán és alkén elegyet képeznek. (0,75 p)
(2) Katalizátor. (0,25 p)
(3) A kísérlet során gázhalmazállapotú termékek keletkeznek a paraffingyertyából. Ezek közül a levegőnél könnyebbek távozhatnak a rendszerből, ha „nyílt kémcsőbe” (szájával felfele fordítva) fogjuk fel, pl. CH4 , C2H4). (1,0 p)
(4) Fizikai tulajdonságok: szín (színtelenek) és halmazállapot (gáz). (0,25 p)
(5) CH4; C2H6; C3H8; C4H10; C2H4; C3H6; C4H8 . (1,0 p)
7. a) (4,0 p)
|
|
4,9 |
1,7 |
2,8 |
2,4 |
6,9 |
1,7 |
1,9 |
2,8 |
5,7 |
|
|
3,8 |
6 |
3 |
8 |
4 |
9 |
7 |
1 |
2 |
5 |
1,5 |
|
TAL |
ORM |
SOL |
NÉL |
NTA |
SPO |
AZE |
RRÁ |
,AN |
||
|
1,4 |
4 |
1 |
2 |
3 |
6 |
5 |
9 |
8 |
7 |
7,9 |
|
NAG |
LÁG |
S–É |
ÁLI |
ÁBA |
NÁL |
MEG |
VAD |
NT● |
||
|
5,9 |
9 |
7 |
5 |
2 |
8 |
1 |
4 |
3 |
6 |
3,6 |
|
FEL |
ACI |
KIS |
SOL |
ÁSP |
AZÓ |
YOB |
SLÁ |
NAN |
||
|
1,5 |
1 |
5 |
4 |
8 |
2 |
6 |
7 |
9 |
3 |
3,9 |
|
SZÉ |
EBB |
BMÉ |
ONT |
VAD |
NÁL |
KLO |
ELŐ |
NCÚ |
||
|
2,8 |
2 |
8 |
6 |
7 |
3 |
9 |
5 |
4 |
1 |
1,5 |
|
ÁSP |
JAI |
NAG |
ALK |
IZO |
NOR |
AFO |
RTÉ |
NLÁ |
||
|
3,9 |
3 |
9 |
7 |
1 |
5 |
4 |
2 |
6 |
8 |
2,8 |
|
MÉR |
MÁL |
ÁNO |
NCÚ |
RRÁ |
KŰA |
ONT |
YOB |
SMA |
||
|
1,6 |
5 |
6 |
1 |
9 |
4 |
8 |
3 |
7 |
2 |
2,7 |
|
SPO |
BAZ |
ALK |
ALK |
ZEL |
GAS |
EIK |
KFO |
JAE |
||
|
3,7 |
7 |
4 |
3 |
6 |
1 |
2 |
8 |
5 |
9 |
5,9 |
|
RRÁ |
ÁGA |
TŐL |
OLV |
ÁNO |
LTÉ |
ABB |
NTÉ |
ÁNO |
||
|
2,9 |
8 |
2 |
9 |
5 |
7 |
3 |
6 |
1 |
4 |
1,6 |
|
,MI |
RAN |
KÉ● |
SÁL |
S–É |
:MI |
ADÁ |
KFO |
ZÁS |
||
|
|
5,8 |
2,6 |
1,9 |
5,9 |
1,7 |
2,8 |
3,8 |
1,7 |
2,9 |
|
b) Az elágazó szénláncú alkánok forrás- és olvadáspontja eltér a normális láncú
izoméreiktől: minél nagyobb mértékű az elágazás, annál kisebb a forráspont és
általában annál nagyobb az olvadáspont. A cikloalkánok forrás- és olvadáspontja is
magasabb, mint a megfelelő normál alkánoké. (1,0 p)
c1) A normál C-láncú alkánok molekuláiban a kapcsolódó C-atomok tetszőlegesen elfordulhatnak a C–C kötések mentén, így ezek csak „elnyúlt” molekulák formájában léteznek. Ezzel szemben az elágazó C-láncú alkánok közel gömb alakúak: minél több az elágazás annál jobban közelítik a gömb alakzatot.
Az „elnyúlt” molekulák nagyobb felületen érintkezhetnek egymással, mint a gömb alakzatúak, így az utóbbiak között gyengébbek az intermolekuláris kölcsönhatások, amelyeknek felszakításához kevesebb energia szükséges. Ezzel magyarázható, hogy minél több az elágazás, annál kisebb a forráspont érték. (1,75 p)
Pl. n–C6H14 , f.p. = 69 oC; 3-metil-pentán, f.p. = 63 oC; 2,2-dimetil-butá: f.p. = 50 oC
vagy: n–C5H10 , f.p. = 36 oC; 2,2-dimetil-propán: f.p. = 10 oC (0,25 p)
A gömb, vagy közel gömb alakú molekulák könnyen rendeződnek el szabályos kristályrácsba, így a közöttük létező vonzóerők is nagyobbak. (Az „elnyúltabb” molekulák nehezen rendeződnek szabályos kristályrácsba.) Ezzel magyarázható, hogy minél több az elágazás, annál nagyobb az olvadáspont értéke. (0,5 p)
Pl. 3-metil-pentán, o.p. = – 118oC; 2,2-dimetil-bután, o.p. = – 98 oC (0,25 p)
c2) A gyűrűs vegyületek merevebb szerkezetűek, mint a nyílt láncúak (nincs C–C szabadforgásra lehetőség). Ezért az előbbiek nagyobb felületen érintkezhetnek egymással, így „eltávolításukhoz” több energia szükséges (o.p. és f.p.), mint a megfelelő „elnyúlt” C-láncú molekulák esetében. (0,75 p)
Pl. ciklohexán, f.p. = 81 oC és o.p. = 6,5 oC; n-hexán, f.p. = 69 oC és o.p. = – 95 oC (0,25 p)
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
8. a) Nyílt C-láncot tartalmazó szerves vegyületek (= alkán, alkán, alkin és ezek származékai)
(0,5 p)
b) Ciklusos (gyűrűs) alifás (lásd a)-válasz) vegyületek. (0,5 p)
c) A normál-dekanol Na-sója: CH3(CH2)8–CH2O–Na+ (0,5 p)
d) Etánamid = acetamid: CH3CONH2 (0,25 p)
(1) CH3COONH4 ® CH3CONH2 + H2O (0,5 p)
(2) CH3COCl + 2NH3 / NH3 ® CH3CONH2 + NH4Cl / HCl (0,5 p)
(3) (CH3CO)2O + + 2NH3 ® CH3CONH2 + CH3COONH4 (0,5 p)
(4) CH3COOC2H4 + NH3 ® CH3CONH2 + C2H5OH (0,5 p)
e) C- és O-atomokból felépülő, nagy gyűrűket tartalmazó szerves molekulák (=makrociklusos poliéterek); elsőként a „18-korona-6” vegyületet szintetizálták: összesen 18 atomos gyűrű, amelyből 6 db- O-atom: C12H24O6
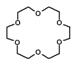 (1,5
p)
(1,5
p)
f) Az 1,3-butadién (buta-1,3-dién) és a propenonitril kopolimerje (sokféle oldószerrel és olajjal szemben ellenálló gumi): –[(H2C–CH=CH–CH2)x–(CH2–CHCN)y] n– (1,0 p)
g) Alkánok egy H-atomja helyett egy – NO2 csoportot tartalmazó szerves vegyületek.
 Általános
képlet: CnH2n+1NO2 ; a homológ
sor 12. tagja: C12H25NO2 , mononitro-dodekán
(1,0 p)
Általános
képlet: CnH2n+1NO2 ; a homológ
sor 12. tagja: C12H25NO2 , mononitro-dodekán
(1,0 p)
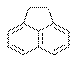
h) molekulaképlete: C12H10
3 kondenzált gyűrűt tartalmaz: egy 5 –tagú és két 6-tagú gyűrűt
(1,0 p)
![]() i) (0,25
p)
i) (0,25
p)
más elnevezések:
(1) 2,3,5,6-dibenzo-piridin: a piridin 2-3 és 5-6 –os C-atojaihoz kapcsolódik két benzolgyűrű,
(2) egyszerűen csak: dibenzopiridin; a piridin gyűrűhöz 2 benzolgyűrű kapcsolódik
(3) 10-azo-antracén; az elnevezés azt jelzi, hogy az antracén 10-es C-atomja helyén N-atom található. (2x0,75=1,5 p)