X.-XII. osztály, III. forduló, megoldás
2014 / 2015 –ös tanév, XX. évfolyam
1. a) (1) 1db. C6H5–CH2– + 2db. C6H5– + 7 C-atom a főláncban = 26 C-atom (0,75 p)
(2) 2db. C6H5– + 1db. –C6H4–CH3 + 1db. H3C–C6H4–CH2– + 10 C-atom a főláncban =
37 C-atom (1,0 p)
(3) 1db. C6H5–CH2– + 1db. C6H5– + 1db. CH3–C6H4–CH2– + 1 db. CH3–C6H4– + 1db. C-atom a
főláncban = 29 C-atom (1,0 p)
Megjegyzés: - a feladatlapon szereplő elnevezés alapján (szerkezet nem kellett!):
7+6+7+7+1=28 C-atom (1,0 p); tévedés volt a feladatlapon, mert benzil-fenil-(meta-metil-
benzil)-paratolil-metán kellett volna, amelyben 29 C atom van.
(4) 1db. C10H7– + 1db. C2H5– + 1db. C6H5– + 5db. CH3– + 1db. (CH3)2C6H3– + 1db. C2H3– + 15
C-atom a főláncban = 48 C-atom (1,25 p)
b) 1 db. C=C kötés: TE= 1; 1 db. C≡C kötés: TE= 2; 1 db. gyűrű: TE= 1;
(1) 1 db. C6H5–CH2– : 1 gyűrű + 3 db. C=C ® TE = 4
2 db. C6H5– : 2 gyűrű + 2x3 db. C=C ® TE = 8 ; főlánc: 2 db. C=C ® TE = 2;
összes TE = 14 (1,0 p)
(2) 2 db. C6H5– : 2 gyűrű + 2x3 db. C=C ® TE = 8;
1 db. C6H5–CH3 : 1 gyűrű + 3 db. C=C ® TE = 4;
1 db. CH3– C6H4–CH2– : 1 gyűrű + 3 db. C=C ® TE = 4; főlánc: 3 db. C=C
összes TE = 19 (1,25 p)
(3) 1 db. C6H5–CH2– : 1 gyűrű + 3 db. C=C ® TE = 4;
1 db. C6H5– : 1 gyűrű + 3 db. C=C ® TE = 4 ;
1 db. CH3– C6H4–CH2– : 1 gyűrű + 3 db. C=C ® TE = 4;
1 db. CH3– C6H4– : 1 gyűrű + 3 db. C=C ® TE = 4;
összes TE = 16 (1,0 p)
(4) 1 db. C10H7– : 2 gyűrű + 5 db. C=C ® TE = 7;
1 db. C6H5– : 1 gyűrű + 3 db. C=C ® TE = 4 ;
1 db. ( CH3)2C6H3– : 1 gyűrű + 3 db. C=C ® TE = 4;
1 db. C2H3– : 1 db. C=C ® TE = 1; főlánc: 2 db. CºC + 1 db. C=C ® TE = 5;
összes TE = 21 (1,25 p)
c) - minden esetben a C=C, ill. CºC kötések telítődnek, de a gyűrűk megmaradnak és ezeknek a száma adja a TE-t: (1) TE = 3; (2) TE = 4; (3) TE = 4; (4) TE = 4 (1,0 p)
d) - legyen CXHY általános képletű szénhidrogén, TE = [(2X+2)–Y] / 2 összefüggés alapján vagy CnH(2n+2) – 2TE alapján számolható (1,0 p)
(1) 14 = (2x26+2) – Y / 2 Y = 26 vagy C26H2x26+2 – 2x14 C26H26 (0,25 p)
(2) 19 = (2x37+2) – Y / 2 Y = 38 vagy C37H2x37+2 – 2x19 C37H38 (0,25 p)
(3) 16 = (2x28+2) – Y / 2 Y = 26 vagy C28H2x28+2 – 2x16 C28H26 (0,25 p)
(4) 21 = (2x48+2) – Y / 2 Y = 56 vagy C48H2x48+2 – 2x21 C48H56 (0,25 p)
2. (1) – alkanolok: a) CnH2n+2O /CnH2n+1OH b) monohidroxi vagy egyértékű c) telített
d) nyílt e) CH3OH f) metanol / metilalkohol g) faszesz (1,25 p)
(2) – alkándiolok: a) CnH2n+2O2 /CnH2n( OH)2 b) dihidroxi vagy kétértékű c) telített
d) nyílt e) HO–CH2–CH2-OH f) etándiol /etán-1,2-diol g) glikol (1,25 p)
(3) – alkántriolok: a) CnH2n+2O3 /CnH2n-1( OH)3 b) trihidroxi vagy háromértékű c) telített d) nyílt. e) HO–CH2–CH(OH)–CH2-OH f) propántriol / propán-1,2,3-triol g) glicerin (1,25 p)
(4) – cikloalkánolok: a) CnH2nO /CnH2n-1OH b) monohidroxi vagy egyértékű c) telített
d) gyűrűs e) C5H9OH f) ciklopentanol g) ------ (1,25 p)
(5) – alkénolok: a) CnH2nO /CnH2n-1OH b) monohidroxi vagy egyértékű c) telítetlen
d) nyílt e) H2C=CH–CH2–OH f) propénol / 2-propén-1-ol g) allil-alkohol (1,25 p)
(6) – alkinolok: a) CnH2n-2O /CnH2n-3OH b) monohidroxi vagy egyértékű c) telítetlen
d) nyílt e) HCºC–CH2–OH f) propinol / 2-propin-1-ol g) ------- (1,25 p)
3. a) Mind a 2 vegyület csak C- és H-atomokat tartalmaz (C2H4, C6H5–CH=CH2). A polimerizáció során a kémiai összetétel nem változik, hanem a polimer molekulatömege többszöröse lesz a kiinduló molekula tömegének, mivel csak a pi-kötések felszakadásából származó vegyértékeken keresztül kapcsolódnak össze a molekulák. (0,75 p)
b) C2H4 + 3O2 ® 2CO2 + 2H2O és C8H8 + 10O2 ® 8CO2 + 4H2O (0,5 p)
- a polimerek égési folyamatai:
–(CH2CH2)n– + 3nO2 ® 2nCO2 + 2nH2O és –[CH(C6H5) CH2]n– + 10nO2 ® 8nCO2 + 4nH2O (1,0p)
1 mól etén ® 2 mól CO2 / 2 mól H2O = 1 / 1
1 mól polietén ® 2n mól CO2 / 2n mól H2O = 1 / 1 (0,25 p)
1 mól sztirol ® 8 mól CO2 / 4 mól H2O = 2 / 1
1 mól polisztirol ® 8n mól CO2 / 4n mól H2O = 2 / 1 (0,25 p)
Az elégetett monomerek és a belőlük keletkezett polimerek égési folyamatában azonos
mólarányban keletkeznek az égéstermékek (magyarázat – a)-válasz) (0,25 p)
c) A b)-ben megadott reakciók a gyakorlatban használt két polimer fő kémiai komponenseinek az égését tüntetik fel. Ezek mellett viszont, a felhasználási területtől függően az anyag tartalmaz: lágyító vagy keményítő szereket, antioxidánsokat, színezékeket, stb., ú.n. adalékanyagokat, amelyek az égés során nagyon sokféle terméket eredményeznek – legtöbb az élő szervezet számára káros. (1,0 p)
d) A polietilén tartalmú tárgyak égési reakcióinak termékei: aceton, akrolein, , benzol, ciklopentanol, ecetsav, formaldehid, hangyasav, mertanol, szénmonozid, tolul. (1,0 p)
A polisztirol tartalmú tárgyak égési reakcióinak termékei: benzaldehid, benzol, etilbenzol,
formaldehid, izobutén, naftalin, propilén, sztirol, toluol. (1,0 p)
(Egészségkárosító hatásukról a feladatlap Tudod-e? –ben olvashatsz.)
4. a) 2
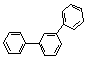
gyűrű: ![]() difeni / bifenil, C12H10
(0,25 p)
difeni / bifenil, C12H10
(0,25 p)
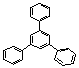
3
gyűrű: ![]() 1,4-difenil-benzol / p-difenil-benzol /terfenil;
C18H14
1,4-difenil-benzol / p-difenil-benzol /terfenil;
C18H14
![]()
1,2-difenil-benzol / 1,3-difenil-benzol /
o-difenilbenzol; C18H14 m-difenilbenzol; C18H14 (0,75 p)
4
gyűrű: ![]()
![]()
bis-difenil/ 3,3’-difenil-difenilén /
p,p’-difenil-difenilén; C24H18 m,m’-difenil-difenilén; C24H18
2,2’-difenil-difenilén
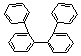
2,2’-difenil-difenilén / 1,3,5-trifenil-benzol; C24H18 (1,25 p)
o,o’-difenil-difenilén; C24H18
b) Molekulatömegek: M(C12H10) = 154 M(C18H14) = 230 M(C24H18) = 306 (0,75 p)
- a megadott elegy tömege g-ban: m = 154 + 3x230 + 4x306 = 2068 (0,75 p)
- C-tartalom: C% = 12(12+3x18+4x24)100/2068 = 94 % C (0,75 p)
c) - a telített oldalláncokban a legkisebb a C/H tömegarány, ( ill. legnagyobb a H/C tömegarány) az összes szénhidrogén csoportok közül, így az elegy tömeg %-os C-tartalma csökken a telített oldalláncok számának és azok C-atom számának növekedésével. (0,75 p)
d) Egy gyűrű vagy 1 pi-kötés = 1 TE
- két izolált gyűrű = 2 gyűrű + 6 pi-kötés ® TE = 8
- három izolált gyűrű = 3 gyűrű + 9 pi-kötés ® TE = 12
- négy izolált gyűrű = 4 gyűrű + 12 pi-kötés ® TE = 16 (2,0 p)
e1) - alkánok általános képlete: CnH2n+2 (telített) (0,25 p)
- 2 izolált gyűrű: TE = 8 CnH2n+2-2x8 = CnH2n-14 (0,5 p)
- 3 izolált gyűrű: TE = 12 CnH2n+2-2x12 = CnH2n-22 (0,5 p)
- 4 izolált gyűrű: TE = 16 CnH2n+2-2x16 = CnH2n-30 (0,5 p)
e2) – a harmadik tag 2 C-atommal többet tartalmaz, mint az első tag („a” válasz)
2 gyűrű: CnH2n-14 Þ C14H14 3 gyűrű: CnH2n-22 Þ C20H18 4 gyűrű: CnH2n-30 Þ C26H22
(1,0 p)
5. a) Az etanol korlátlanul elegyedik vízzel és az oldat enyhén felmelegszik, míg a fenol rosszul oldódik vízben (68o C fölötti hőmérsékletű vízben tökéletesen oldódik), zavaros, tejszerű oldat keletkezik. (0,5 p)
Etanolban kis tömegű apoláris rész (C2H5-) kapcsolódik –OH csoporthoz, míg a fenolban jóval nagyobb tömegű az apoláris rész (C6H5-). Mindkét vegyület –OH csoportjai és a víz –OH csoportja közötti H-híd kötések kialakulása miatt történik az oldódás. Ezeknek a kötéseknek a kialakulása energia felszabadulással jár, amely hő fejlődés formájában észlelhető. (1,0 p)
b) Az etanol-oldat nagyon gyengén savas jellegű (gyakorlatilag semleges), míg a fenol oldata erősebb savas jelleget mutat. (0,25 p)
c) H2O < C2H5OH < C6H5OH (0,25 p)
d) A zavaros fenol vizes oldata kitisztul, mert a keletkezett ionos vegyület (C2H5ONa) vízben jól oldódik : C2H5OH + NaOH ® C2H5ONa + H2O (0,75 p)
e) Bázikus kémhatású oldat, mert a keletkezett só egy erős bázisból és gyenge savból származik. (0,5 p)
f) Nem történik változás. Ez azt bizonyítja, hogy a fenol gyengébb savas jellegű, mint a szénsav, ezért nem űzi ki azt sójából, a NaHCO3-ból. (0,75 p)
g) A színtelen C6H5ONa vizes oldata a szénsav hatására ismét zavarossá válik, mivel az oldatból C6H5OH válik ki. Ez azt bizonyítja, hogy a szénsav erősebb sav, mint a fenol, ezért kiűzi azt sójából: C6H5ONa + H2CO3 « C6H5OH + NaHCO3 (1,0 p)
6. b) (1) antracén (2) benzpirén) (3) fenantrén) (4) koronén (5) krizén (6) naftacén (7) naftalin (8) ovalén (9) pirén (10) trifenilén (1,5 p)
c) (1)
![]() C14H10 (0,2
p) (2)
C14H10 (0,2
p) (2) ![]() C20H12 (0,35 p)
C20H12 (0,35 p)
(3)
![]() C14H10 (0,2
p) (4)
C14H10 (0,2
p) (4) 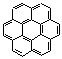 C24H12 (0,55
p)
C24H12 (0,55
p)
(5)
![]() C18H12 (0,35 p) (6)
C18H12 (0,35 p) (6)
![]() C18H12 (0,35 p)
C18H12 (0,35 p)
(7)
![]() C10H8 (0,15
p) (8)
C10H8 (0,15
p) (8) 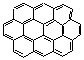 C32H14 (0,65
p)
C32H14 (0,65
p)
(9)
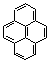 C16H10 (0,35
p) (10)
C16H10 (0,35
p) (10) 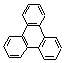 C18H12 (0,35
p)
C18H12 (0,35
p)
d) Kondenzált helyzetben vannak, vagyis orto-helyzetű C-atomon keresztül kapcsolódnak a gyűrűk egymással (= a benzol gyűrűknek közös oldaluk van más gyűrűkkel) (0,5 p)
e) Izomerek egymással: (1) és (3); (5), (6) és (10) (0,5 p)
a) (4,0 p)
|
18 8 |
3 |
12 6 |
7 |
4 |
4 1 |
2 |
13 9 |
5 |
|
N |
T |
C |
R |
Z |
B |
E |
N |
N |
|
9 |
7 4 |
2 |
15 8 |
6 |
8 5 |
4 1 |
9 7 |
3 |
|
● |
R |
N |
É |
I |
P |
F |
R |
N |
|
7 1 |
14 5 |
7 |
13 3 |
9 |
2 |
4 |
15 6 |
8 |
|
A |
A |
É |
N |
N |
E |
A |
T |
É |
|
7 |
8 |
10 5 |
6 |
7 1 |
18 9 |
4 3 |
2 |
4 |
|
É |
N |
O |
● |
R |
F |
C |
A |
É |
|
7 2 |
13 9 |
3 |
4 |
5 |
8 |
7 |
6 1 |
6 |
|
K |
K |
O |
É |
N |
A |
A |
T |
N |
|
6 |
4 1 |
4 |
6 2 |
3 |
12 7 |
12 5 |
18 8 |
9 |
|
N |
● |
R |
I |
Z |
N |
N |
F |
T |
|
13 5 |
7 |
1 |
15 9 |
16 8 |
4 |
6 |
3 |
2 2 |
|
● |
V |
A |
T |
● |
I |
I |
F |
I |
|
6 3 |
2 |
18 9 |
5 |
7 |
15 6 |
8 |
4 |
1 |
|
I |
L |
L |
R |
N |
É |
É |
E |
R |
|
11 4 |
6 |
8 |
4 1 |
2 |
13 3 |
9 |
11 5 |
7 |
|
N |
O |
A |
É |
N |
P |
N |
N |
L |
CSAK XI.-XII. OSZTÁLYOS VERSENYZŐKNEK KÖTELEZŐ FELADATOK:
8. a)
|
S. sz. |
Rövidí-tés |
Elnevezés |
Monomer szerkezete |
Ismétlődő egységek |
|
1. |
PE |
polietilén (0,2) |
H2C=CH2 (0,2) |
–( H2C–CH2)n– (0,3) |
|
2. |
PP |
polipropilén (0,2) |
H2C=CH–CH3 (0,2) |
–[ H2C–CH2(CH3)]n– (0,3) |
|
3. |
PBD |
polibutadién (0,2) |
H2C=CH–CH=CH2 (0,2) |
–(H2C–CH=CH–CH2)n – (0,3) |
|
4. |
PVF |
poli(vinil-fluorid) (0,2) |
H2C=CHF (0,2) |
–( H2C–CHF)n– (0,3) |
|
5. |
PIB |
poli(izobutilén) (0,2) |
H2C=CH(CH3)2 (0,2) |
–[H2C–CH(CH3)]2– (0,3) |
|
6. |
PTFE |
poli(tetrafluor-etilén) (0,2) |
F2C=CF2 (0,2) |
–( F2C–CF2)n– (0,3) |
|
7. |
PS |
polisztirol (0,2) |
H2C=CH–C6H5 (0,2) |
–[ H2C–CH2(C6H5)]n– (0,3) |
|
8. |
PAN |
poli(akril-nitril) (0,2) |
H2C=CH–CN (0,2) |
–[ H2C–CH2(CN)]n– (0,3) |
|
9. |
ABS |
akrilnitril-butadién-sztirol (0,3) |
H2C=CH–CN H2C=CH–CH=CH2 H2C=CH–C6H5 (0,3) |
–[ H2C–CH2(CN)]x––(H2C–CH=CH– –CH2)y–[ H2C–CH2(C6H5)]z– (0,8) |
b) PE – szemetes konténerek, tisztítószeres palackok, zsákok, csomagolóanyag, sátorfólia, stb.
PP – élelmiszerek tárolása, játékok, sportszerek, kerti bútorok, ragasztószalagok, kötelek, stb.
PBD – gumiabroncsok, labdák, stb.
PVF – különböző iparágakban hőcserélők, szivattyúk, szűrők, stb.
PIB - kaucsukgyártás
PTFE – teflon – védőruhák egyik rétege, háztartási és élelmiszeripari edények felületének ragadás mentesítése, stb.
PS – hő- és hangszigetelő, csomagolóanyag, villamos ipari alkatrészek, textíliák, stb.
PAN – fogkrém tubusok belső rétege, textiliparban felsőruházati szövetek, stb.
ABS – autóipar – műszerfal burkolat, hűtőszekrények belső borítása, mobiltelefonok külső burkolata, biztonsági sisakok, monitor, nyomtató, billentyűzet borítása, stb. (0,5x6=3,0 p)