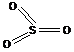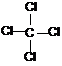IX. osztály, III. forduló, megoldás
2014 / 2015 –ös tanév, XX. évfolyam
1. (4,25 p)
|
S. sz. |
„Érdekes”/„furcsa” név |
Képlet |
Kémiai (szisztematikus) név (vagy az összetételre vonatkozó más név) |
|
1 |
musszívarany |
SnS2 (0,3p) |
óndiszulfid; ón(II)-szulfid (0,2 p) |
|
2 |
krómsárga |
PbCrO4 (0,3p) |
ólom(II)-kromát (0,2 p) |
|
3 |
ólomsavanhidrid |
PbO2 (0,3p) |
ólomdioxid; ólom(IV)-oxid (0,2 p) |
|
4 |
aranysó |
NaAuCl4●2H2O (0,3p) |
nátrium-arany(III)-klorid (0,2 p) |
|
5 |
„fém-klorür” (min.3) |
PbCl2; Hg2Cl2; CuCl (0,6p) |
ólom(II)-klorid; higany(I)-klorid; réz(I).klorid (0,6p) |
|
6 |
kalgon |
(NaPO3)6 (0,3p) |
hexanétrium-hexametafoszfát; hexa(n-trium-metafoszfát) (0,2 p) |
|
7 |
uránsárga |
Na2U2O7 (0,3p) |
nátrium-uranát; nátrium-urán(VI)-oxid (0,25 p) |
2. a) (2,5 p)
|
szám |
toldalék |
jel |
szám |
toldalék |
jel |
szám |
toldalék |
jel |
szám |
toldalék |
jel |
|
0 |
nil |
n |
3 |
tri |
t |
6 |
hex |
h |
8 |
oct |
o |
|
1 |
un |
u |
4 |
quad |
q |
7 |
sept |
s |
9 |
enn |
e |
|
2 |
bi |
b |
5 |
pent |
p |
|
|
|
|
|
|
b) (3,0 p)
|
Z |
ideiglenes név |
vegyjel |
Z |
ideiglenes név |
vegyjel |
|
121 |
unbiunium |
Ubu |
176 |
unsepthexium |
Ush |
|
132 |
untribium |
Utb |
187 |
unoctseptium |
Uos |
|
143 |
unquadtrium |
Uqt |
198 |
unennoctium |
Ueo |
|
154 |
unpentquadium |
Upq |
199 |
unennennium |
Uee |
|
165 |
unhexpentium |
Uhp |
200 |
binilnilium |
Bnn |
Megj. Z=166 helyett 199 kellett volna, de természetesen a 166-t pontoztam: unhexhexium; Uhh
3. (32x0,2=6,4 p)
|
|
H2S |
SO3 |
CCl4 |
CO2 |
|
a) – szerkezet |
1. |
2.
|
3.
|
4. |
|
b) – szigma-elektronok száma |
5. 4 |
6. 6 |
7. 8 |
8. 4 |
|
c) – pi-elektronok száma |
9. 0 |
10. 6 |
11. 0 |
12. 4 |
|
d) – nemkötő elektronpárok száma |
13. 2 |
14. 6 |
15 12 |
16. 4 |
|
e) – központi atom vegyértéke |
17. 2 |
18. 6 |
19. 4 |
20. 4 |
|
f) – kötésszög értéke |
21. 92o |
22. 120o |
23. 109o28’ |
24. 180o |
|
g) – kötések polaritása (poláris/apoláris) |
25. poláris |
26. poláris |
27. poláris |
28. poláris |
|
h) – molekula polaritása (poláris/apoláris) |
29. poláris |
30. apoláris |
31. apoláris |
32. apoláris |
A H2S molekula nem szimmetrikus, míg a többi 3 molekula szimmetrikus szerkezetű, így ez utóbbiakban a molekulán belüli polaritás kiegyenlítődik és ezért a molekulák apoláris jellegűek. (0,6 p)



![]() 4. a)
4. a)
F2; gáz; sásrgás-zöld Cl2; gáz; zöld Br2; folyékony; vörös-barna I2; szilárd; acélszürke,
de gőzei lila színűek. (3,25 p)
b) Az asztácium; At; Z = 85. Azért hiányzik, mert minden izotópja radioaktív tulajdonságú.
(1,0 p)
c) Z = 117; Uus, ununseptium (0,75 p)
d) Vegyértékhéj szerkezet: ns2np5;
vegyértékelektronok = utolsó héj elektronjai = 7, vegyérték = 1 (0,5 p)
e) Vegyületeikben – 1 és + 7 között váltakozhat az oxidációs számuk, ill. a vegyértékük
1 – 7 között lehet, de nem mindegyiknek. (0,25 p)
- a F – a legelektronegatívabb kémiai elem, így csak – 1 o.sz. , ill. 1 vegyértékű lehet vegyületeiben: ionos vegyületekben felvesz 1 elektront, kovalens kötés esetén csak negatív pólus lehet. 1s22s22p5 konfigurációból adódik, hogy mindössze egy hely van üresen az orbitáljaiban. Pl. NaF, MgF2, HF, stb. (0,5 p)
- a Cl – o.sz. értékei lehetnek: – 1, + 1, + 3, + 4, + 5, + 6 és + 7, ill. vegyértéke: 1, 3, 4, 5, 6, 7 lehet (a +4 és +6 ritkább); (0,25 p)
- a konfigurációból: [Ne]3s23p53do adódik, hogy a 3p alhéj kiegészítésén kívül a 3d alhéjra is fogadhat be elektronokat (0,5 p)
– 1 o.sz. : fémekkel, vagy kisebb elektronegativitású nemfémmel: NaCl, HCl (0,25 p)
+1 o.sz. : nagyobb elektronegativitású nemfémmel: ClF, Cl2O, HOCl (0,25 p)
+ 3 o.sz. = vegyérték 3: HClO2 ; + 4 o.sz. = vegyérték 4: ClO2 ;
+ 5 o.sz. = vegyérték 5: HClO3 , Cl2O7; + 6 o.sz. = vegyérték 6 : Cl2O6
+ 7 o.sz. = vegyérték 7: Cl2O7; HClO4 (0,5 p)
- a Br és a I a klórhoz hasonló vegyérték állapotban fordulhatnak elő, mivel a konfigurációjuk hasonló: [Ar]4s23d104p54do , ill. : [Kr]5s24d105p55do (0,5 p)
(mindkét esetben az 1 vegyérték állapot a leggyakoribb, atöbbi ritkább, instabil vagy nem ismert)
Br: – 1 : HBr; + 1 : HBrO, Br2O; + 3: NaBrO2; + 5: HBrO3; + 7: NaBrO4 (0,5 p)
I: – 1 : HI; + 1 : HIO; + 3: NaIO2; + 5: HIO3 , NaIO3 ; + 7: NaIO4 (0,5 p)
f) A nemfém atomok között kovalens kötés alakul ki. Vegyértékből következik: itt egyszeres kovalens kötés van, amely apoláris, mivel azonos atomok kapcsolódnak össze. (0,75 p)
g) A kötéstávolság = kapcsolódó atomok magjai közti távolság. Így a kisebb térfogatú atomok közötti kötéstávolság is kisebb; az a)-válasz alapján: F2, Cl2, Br2, I2 sorrendben nő (142 pm, 199 pm, 228 pm, 267 pm). (0,5 p)
h) (1,2 p)
|
S.sz. |
+/– |
S.sz. |
+/– |
S.sz. |
+/– |
S.sz. |
+/– |
S.sz. |
+/– |
S.sz. |
+/– |
|
1 |
+ |
2 |
+ |
3 |
+ |
4 |
– |
5 |
+ |
6 |
+ |
|
7 |
– |
8 |
– |
9 |
+ |
10 |
– |
11 |
– |
12 |
– |
A F® Cl ® Br ® I sorrendben csökken a reakciókészség, illetve az elektronfelvevő képesség. A reakcióképesebb halogén elem kiűzi (=helyettesíti) a kevésbé reakcióképes halogént (halogenid ion formájában) vegyületeiből. (0,8 p)
i) Az o.p. = szilárd állapot ® cseppfolyós állapot átalakulás. A jód standard körülményeken szilárd állapotú, ezért o.p.-ja > 0o C. (0,25 p)
j) A f.p. = cseppfolyós állapot ® gázállapot átalakulás. A bróm cseppfolyós , a jód szilárd állapotú standard körülményeken, így ennek a kettőnek lesz a f.p.-ja > 0o C (bróm: 59o C, jód: 184o C). (0,5 p)
k) Fluor – legelektronegatívabb elem (= az összes kémiai elem közül a legnagyobb a reakcióképessége);
Bróm – standard körülményeken egyetlen folyékony halmazállapotú nemfém,
Jód – melegítve szublimál. (0,75 p)
l) Cl > F > Br > I (0,19; 0,065; 6x10–4; 6,1x10–6). (0,25 p)
m) Mind a 4 halogén mérgező, elsősorban a légzőszervekre és bőrre kifejtett maró hatásuk miatt.
F – rendkívül maró hatású, mivel a legreakcióképesebb elem,
Cl – elsősorban a nyálkahártyát izgatja, jó vízoldhatósága miatt főleg a felső légutakat támadja;
Br – a bőrön súlyos felmaródásokat okoz, gőzei a nyálkahártyát irritálják;
I – emberi és állati szervezet számára kisebb mennyiségben (0,2 mg/nap) nélkülözhetetlen, nagyobb mennyiségben mérgező. (1,25 p)
n) - halogenidek – a halogén o.sz. = – 1; halogenátok – a halogén o.sz. mindig „+”. (0,25 p)
o) F: 19F; Cl: 35Cl és 37Cl; Br: 79Br és 81Br; I: 127I (0,5 p)
p) Nagy reakciókészségük miatt egyik sem fordul elő elemi állapotban a természetben, kivéve a klórt, amely bizonyos vulkánkitörések gázkeverékében felszínre kerül. (0,5 p)
5. A) a) 0,25 dm3 = 250 ml;
- a napi cukoradag / 0,5 liter üdítő = 5x10,5 = 52,5 g cukor = 10,5 db. kockacukor/nap
- 1 hét alatt: 7x10,5 = 73,5 db. kicsi kockacukor (1,25 p)
b) – sok ez a cukoradag a szervezet számára egy egyszerű meggondolás alapján: a 0,5 literes üdítőn kívül még nagyon sok cukortartalmú ételt fogyasztunk a napi étkezések során.
- egészségesebb, ha nem fogyasztjuk ezeket az üdítőket; a nulla cukortartalmúak is sok nem természetes adalékanyagot tartalmaznak.
(Napi cukorszükséglet: nőknek 25 g férfiaknak 37 g). (0,5 p)
B) a) 10 ml permetezőszer + 10000 ml víz = 10010 ml oldat
V/V% = 10x100/10010 = 0,0999 V/V% (0,75 p)
b) Vkeverék = Voldószer = 10 liter = 10000 ml és Vf.a. = 10 ml
V/V% = 10x100/10000 = 0,1 V/V% (0,5 p)
- a koncentráció különbség: = 0,1 – 0,0999 = 10–4 (0,25 p)
- a hiba% a reális koncentrációhoz viszonyítva = 10–4 x100/0,0999 = 0,1 % (0,25 p)
6. a1) A kezdeti oldatok színtelenek; a reakció során mindkét esetben színváltozás történik_ első esetben a kiváló brómtól sárgásbarna, a másodikban a kiváló jódtól halványbarnára színeződik az oldat. (1,25 p)
a2) A 4h) feladata (5) és (6)-os reakciói felelnek meg a fenti átalakulásoknak. (0,5 p)
b) Az eredeti halványbarna színű vizes oldatból a CCl4 kioldja a jódot; két fázis lesz a kémcsőben: alól a lila színű CCl4 –os jódoldat és felül a víz. A I2 molekula apoláris és a CCl4 is apoláris (szimmetrikus szerkezete miatt), míg a víz poláris molekula. A „hasonló szerkezetű anyagok oldódnak egymásban” elv alapján a CCl4 oldja a jódot, amely lila színű és a kémcső alján fog elhelyezkedni, mert a CCl4 sűrűsége nagyobb, mint a víz sűrűsége (az oldott anyag elhanyagolható mértékben változtatja meg a sűrűséget). (1,5 p)
7. a) (4,0 p)
|
9 8 |
1 |
11 2 |
5 |
3 |
4 |
55 6 |
9 |
7 |
|
ET |
ZN |
OG |
E● |
OÁ |
EE |
ET |
ÜE |
LA |
|
4 |
5 |
17 6 |
71 8 |
9 |
7 |
1 |
2 |
23 3 |
|
SÓ |
●E |
K● |
LA |
TL |
● , |
E● |
DO |
●T |
|
9 |
7 |
3 |
1 |
2 |
25 6 |
4 |
5 |
8 |
|
NO |
KN |
AA |
IÖ |
EN |
MT |
TZ |
LZ |
AY |
|
26 3 |
9 |
7 |
2 |
7 6 |
1 |
5 |
33 8 |
4 |
|
K● |
●L |
NÉ |
GÉ |
●E |
TŐ |
ÜS |
BN |
EK |
|
6 |
17 8 |
4 |
14 3 |
5 |
62 9 |
7 |
1 |
19 2 |
|
TM |
K● |
EÉ |
ZL |
GA |
●E |
M● |
RH |
EM |
|
1 |
2 |
44 5 |
23 4 |
7 |
8 |
3 |
41 6 |
9 |
|
AÖ |
LO |
VK |
RS |
KY |
JY |
●H |
LŐ |
LT |
|
11 2 |
4 |
9 |
6 |
1 |
25 3 |
8 |
7 |
5 |
|
AL |
Z● |
KC |
,K |
NZ |
KL |
Á● |
OH |
EÁ |
|
5 |
2 3 |
1 |
7 |
31 8 |
17 2 |
9 |
25 4 |
6 |
|
NN |
●T |
●B |
EG |
ÁG |
NA |
KH |
LE |
Y, |
|
7 |
6 |
73 8 |
9 |
4 |
5 |
5 2 |
3 |
1 |
|
E● |
EA |
UV |
É● |
V● |
Y● |
IT |
AA |
HA |
b) Az interhalogenidek azok a szervetlen vegyületek, melyeknek molekulájában két különböző halogénatom található és ezeknek a száma kettő, négy, hat vagy nyolc lehet. (1,0 p)
c) - az At tartalmúak gyakorlatilag nem léteznek, mert ez radioaktív elem; (0,1 p)
- kétatomos interhalogenidek: ClF, BrF, IF, AtF, BrCl, ICl, AtCl, IBr, AtBr, AtI (0,05x10=0,5 p)
- négyatomos interhalogenidek: F3Cl, F3Br, F3I, F3At, Cl3F, Cl3Br, Cl3I, Cl3At, Br3F, Br3Cl, Br3I, Br3At, I3F, I3Cl, I3Br, I3At, At3F, At3Cl, At3Br, At3I (0,05x20=1,0 p)
- a fentiek közül a F3Cl, F3Br, F3I és Cl3I létezhetnek, mert a kisebb térfogatú atomokból több tud kapcsolódni egy nagyobb térfogatú atomhoz, mint fordítva, ahol a térbeli gátlás akadályozza a kapcsolódást. (0,4 p)
- hatatomos interhalogenidek: F5Cl, F5Br, F5I, F5At, Cl5F, Cl5Br, Cl5I, Cl5At, Br5F, Br5Cl, Br5I, Br5At, I5F, I5Cl, I5Br, I5At, At5F, At5Cl, At5Br, At5I (0,05x20=1,0 p)
- a fentiek közül F5Cl, F5Br, F5I ás Cl5I létezhet; magyarázat: előző csoportnál. (0,3 p)
- nyolcatomos interhalogenidek: F7Cl, F7Br, F7I, F7At, Cl7F, Cl7Br, Cl7I, Cl7At, Br7F, Br7Cl, Br7I, Br7At, I7F, I7Cl, I7Br, I7At, At7F, At7Cl, At7Br, At7I (0,05x20=1,0 p)
- a fentiek közül a F7I létezik (a F7Br-t nem sikerült előállítani) ; magyarázat: előző csoportnál. (0,2 p)